1. По данным о средних ионных коэффициентах активности рассчитайте активность электролитах в следующих растворах:
1. 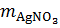 = 0,05
= 0,05
2. mCr2(SO4)3 = 0,2
3. mH2SO4 = 1,0
Запишем выражения связывающие активность соединения с моляльностью:
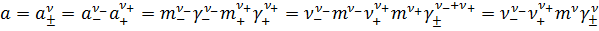
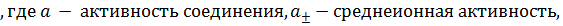
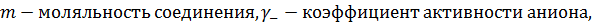
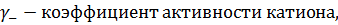
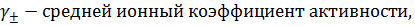
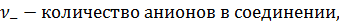

Тогда:

В 72 табл. найдём значение среднего ионного коэффициента активности: γ± = 0,793
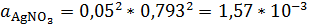

γ± = 0,03
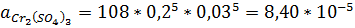
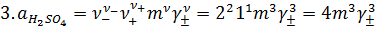
γ± = 0,132
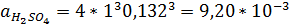
Ответ: aAgNO3 = 1,57*10-3; aCr2(SO4)3 = 8,40*10-5; aH2SO4 = 9,20*10-3.
2. Определите ∆Gº, ∆Hº, ∆Sº, ∆cPº при 298 К для реакции
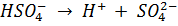
по зависимости 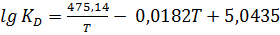
Переведём десятичный логарифм в натуральный, для этого домножим каждое слагаемое на ln10 ≈ 2,303
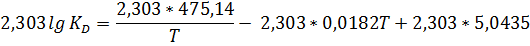
По свойству логарифмов 
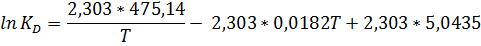
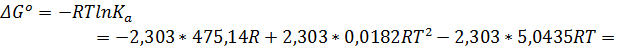
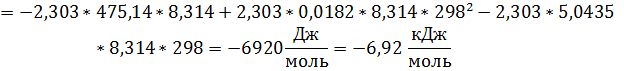
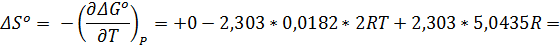
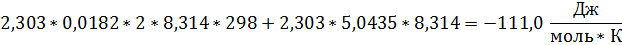
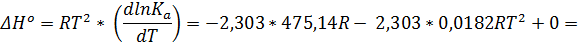
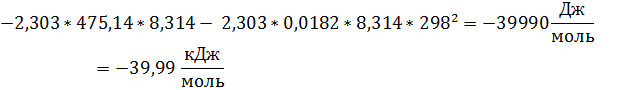

Ответ: ∆Gº = -6,92 кДж/моль, ∆Hº = -39,99 кДж/моль, ∆Sº = -111,0 Дж/(моль*К), ∆cPº = -207,4 Дж/(моль*К).
3. Рассчитайте рН водного раствора уксусной кислоты с концентрацией 0,1 моль/л. Т = 298 К.
Найдём в табл. 75 константу диссоциации уксусной кислоты:
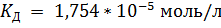
Запишем уравнение разведения Оствальда:
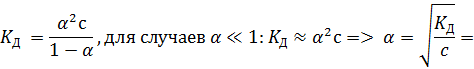
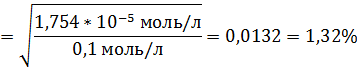
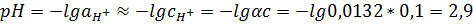
Ответ: pH = 2,9
4. Рассчитайте рН водного раствора азотистой кислоты HNO2 с концентрацией 0,2 моль/л. Т = 18 ºС.
Для самостоятельного решения
КД = 4*10-4 моль/л; α = 4,47%
Ответ: pH = 2,0
5. Рассчитайте рН водного раствора гидроксида аммония с концентрацией 0,05 моль/л. Т = 25 ºС.
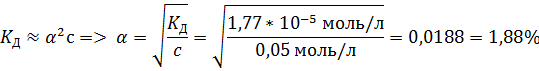
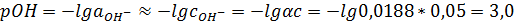
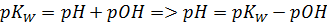
В табл. 67 найдём значение ионного произведения воды:
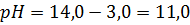
Ответ: pH = 11,0
6. Вычислите ионную силу водного раствора содержащего:
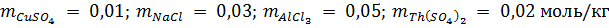
Ионная сила по определению есть:

Тогда,
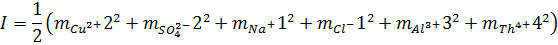
*Обратите внимание, что сульфат и хлорид ионы встречаются в нескольких солях
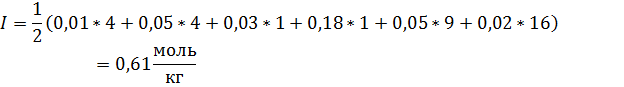
Ответ: I = 0,61 моль/кг
7. Вычислите средний ионный коэффициент электролита HCl в водном растворе с ионной силой равной 0,05 по первому и второму приближению Дебая-Хюккеля и сравните полученные значения со справочными данными. Т = 298К.
1е приближение уравнения Дебая-Хюккеля:
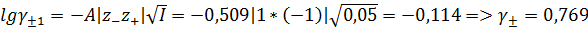
2е приближение уравнения Дебая-Хюккеля:
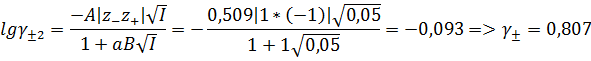
Ответ: γ±1 = 0,769; γ±2 = 0,807; γспр = 0,830
8. Определите молярную электропроводность при бесконечном разведении ионов F- при температуре 25 ⁰С, если молярная электропроводность при бесконечном разведении для Na+ = 50,1 * 10-4 См*м2/моль, NaCl = 126,5 * 10-4 См*м2/моль, KCl = 149,9 * 10-4 См*м2/моль, KF = 128,9 * 10-4 См*м2/моль
Запишем закон независимого движения ионов Кольрауша:
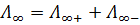
Тогда:
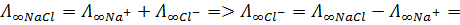
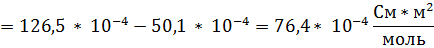
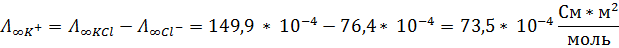
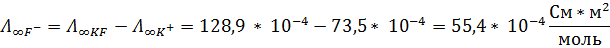
Ответ: 55,4 * 10-4 См*м2/моль
9. Молярная электропроводность раствора уксусной кислоты с разведением 50 л/моль при температуре 25 ⁰С составляет 11,7 * 10-4 См*м2/моль. Определите константу диссоциации, степень диссоциации а также рН раствора.
Разведение – величина обратная молярной концентрации: 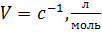
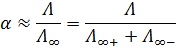
В табл. 65 приведены данные о молярной электропроводности при бесконечном разведении для различных ионов.
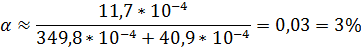
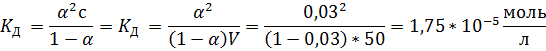
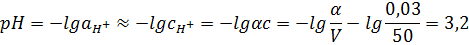
Ответ: Кд = 1,75*10-5 моль/л; α = 3,0 %; рН = 3,2
10. Сопротивления раствора гидроксида аммония с разведением 28 л/моль в ячейке с площадью электродов 5,4 см2 и расстоянием между электродами 0,9 см составляет 778 Ом. Температура 25 ⁰С. Определите константу диссоциации, степень диссоциации а также рН раствора.
В данной задаче молярная электропроводность исследуемого раствора дана в неявной форме.
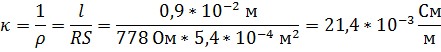
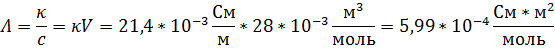
Оставшаяся часть задачи для самостоятельного решения
Ответ: Кд = 1,77*10-5 моль/л; α = 2,2 %; рН = 10,9
11. Подвижность ионов K+ и Cl- составляет 6,1*10-8 и 6,6*10-8 м2/с*В. Рассчитайте числа переноса для этих ионов.
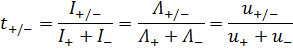
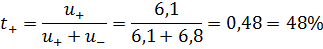
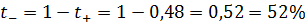
Ответ: t+ = 48% и t- = 52%
12. Рассчитайте подвижность иона Cl- в бесконечно разбавленном растворе при температуре 18 ⁰С.
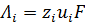
В табл. 65 найдём значение эквивалентной электропроводности для иона хлора при бесконечном разведении:
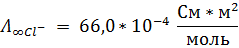

Ответ: 6,84*10-8 м2/с*В
13. Определите растворимость AgIO3 в воде и в водном растворе NaCl с моляльностью 0,01 моль/кг при температуре 25 ⁰С.
В табл. 78 найдём значение произведения растворимости йодата серебра:
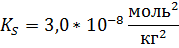
* Размерность произведения растворимости обычно опускают, тем не менее его размерность 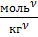 , где ν – количество ионов на которое диссоциирует соль
, где ν – количество ионов на которое диссоциирует соль
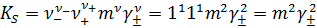
А. В Воде. В воде ионная сила I→0, а средний ионный коэффициент γ±→1, тогда
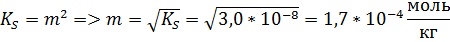
Б. В растворе хлорида натрия.Т.к. сторонний электролит не имеет общих ионов с малорастворимой солью, он влияет на её растворимость только ионной силой. Т.к. йодат серебра малорастворим, то практически не создаёт ионной силы.
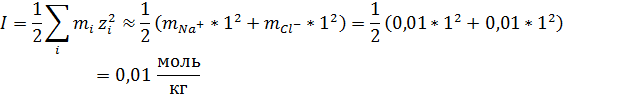
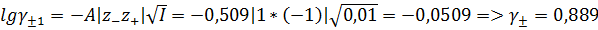
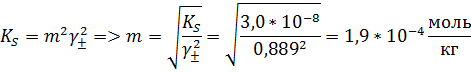
Ответ: m1 = 1,7*10-4 моль/кг; m2 = 1,9*10-4 моль/кг
14. Определите растворимость BaSO4 в воде и в водном растворе Na2SO4 с моляльностью 0,001 моль/кг. Температура составила 25 ⁰С.
В табл. 78 найдём значение произведения растворимости сульфата бария:
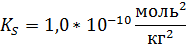
А. В воде.
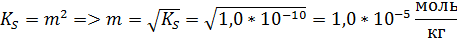
Б. В растворе сульфата натрия. Сульфат натрия имеет общий анион с малорастворимой солью, определяя концентрацию и активность аниона в растворе. Поэтому растворимость сульфата бария необходимо искать по катиона бария.
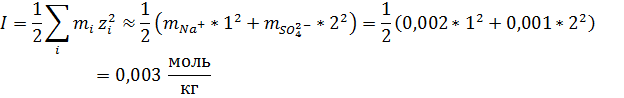
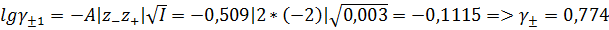
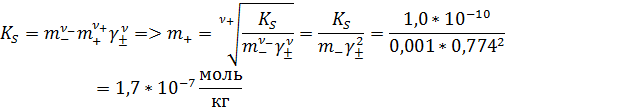
Ответ: m1 = 1,0*10-5 моль/кг; m2 = 1,7*10-7 моль/кг
15. Определите растворимость Cd(OH)2 в водном растворе NaOH с pH = 12 и водном растворе CdCl2 моляльностью 0,0033 моль/кг. Температура составила 25 ⁰С.
Для самостоятельного решения
Ks = 1,8*10-14 моль3/кг3; γ±1 = 0,791
Ответ: m1 = 3,3*10-6 моль/кг; m2 = 3,6*10-10 моль/кг