Теоретическая часть
Тепловой эффект реакции – это теплота, выделенная или поглощенная термодинамической системой при протекании в ней химической реакции.
Процесс растворения твёрдого соединения (соли) с ионной кристаллической решёткой в воде или в каком-либо другом растворителе можно разбить на две стадии:
1. разрушение кристаллической решётки и удаление ионов этой соли на бесконечное расстояние друг от друга (или на расстояние, определяемое объёмом раствора);
2. взаимодействие образовавшихся ионов с молекулами растворителя.
Теплота растворения – тепловой эффект процесса растворения 1 моля вещества в бесконечно большом количестве растворителя. Измеряется в кДж.
Теплота растворения складывается из двух составляющих: теплоты разрушения кристаллической решётки (для твёрдого вещества) и теплоты сольватации.
 (1)
(1)
Интегральная теплота растворения ( ) – тепловой эффект, сопровождающий процесс растворения (при
) – тепловой эффект, сопровождающий процесс растворения (при  ) 1 моля (молярная) или 1 г (удельная) соли в данном количестве растворителя с образованием раствора молярной концентрации
) 1 моля (молярная) или 1 г (удельная) соли в данном количестве растворителя с образованием раствора молярной концентрации  .
.
Прибавление воды к раствору также сопровождается тепловым эффектом – теплотой разведения.
Интегральная теплота разведения – тепловой эффект, наблюдающийся при разбавлении раствора, содержащего 1 моль растворённого вещества, до бесконечного разведения, т.е. до  . Тогда:
. Тогда:
 (2)
(2)
Промежуточная теплота разведения – тепловой эффект, сопровождающий разбавление раствора, содержащего 1 моль растворённого вещества, от концентрации  до меньшей концентрации
до меньшей концентрации  . Она равна разности соответствующих интегральных теплот растворения:
. Она равна разности соответствующих интегральных теплот растворения:
 (3)
(3)
Тепловой эффект, который получается при концентрировании раствора от  до
до  , называется промежуточной теплотой растворения:
, называется промежуточной теплотой растворения:
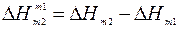 (4)
(4)
Величина теплового эффекта процесса растворения зависит от концентрации полученного раствора, и для данной соли (вещества) можно получить ряд значений теплоты растворения, соответствующих различным концентрациям вещества.
Калориметрическая система.
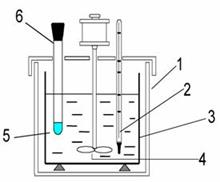
Схема калориметрической системы (лабораторной установки):
1. изотермическая оболочка;
2. термометр;
3. калориметрический стакан;
4. мешалка;
5. калориметрическая жидкость;
6. пробирка с солью.
Тепловой эффект процесса растворения соли в калориметрической системе определяется экспериментально по изменению температуры в калориметре  :
:
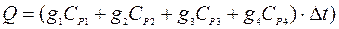 (5)
(5)
где 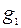 – масса воды, г;
– масса воды, г;  – теплоёмкость воды, (
– теплоёмкость воды, ( );
);  – масса стакана;
– масса стакана;  – теплоёмкость стакана,
– теплоёмкость стакана,  ;
;  – масса термометра, г;
– масса термометра, г;  – теплоёмкость термометра,
– теплоёмкость термометра,  ;
;  – масса мешалки, г;
– масса мешалки, г;  – теплоёмкость мешалки,
– теплоёмкость мешалки,  .
.
Параметры уравнения (5), такие как масса и теплоёмкость стакана, мешалки и термометра можно считать постоянными величинами в процессе эксперимента и объединить сумму их произведений в величину, называемую постоянной калориметра:
 (6)
(6)
Тогда уравнение (5) может быть записано в виде:
 (7)
(7)
где К – постоянная калориметра или теплоёмкость всех частей калориметра и вспомогательных устройств, участвующих в теплообмене, Дж/К;  – изменение температуры в процессе растворения, протекающего в условиях отсутствия теплообмена калориметра с окружающей средой.
– изменение температуры в процессе растворения, протекающего в условиях отсутствия теплообмена калориметра с окружающей средой.
Постоянную калориметра можно предварительно определить из отдельного эксперимента через тепловой эффект процесса растворения соли с известной теплотой растворения (например, KCl или NH4Cl) из выражения:
 (8)
(8)
 (9)
(9)
где 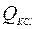 – количество теплоты, которое поглощается при растворении определенного количества KCl (данная соль растворяется с понижением температуры);
– количество теплоты, которое поглощается при растворении определенного количества KCl (данная соль растворяется с понижением температуры);  – изменение температуры при растворении навески соли KCl.
– изменение температуры при растворении навески соли KCl.
Количество теплоты при растворении неизвестной соли определяется по уравнению:
 (10)
(10)
где  – количество теплоты, которое выделяется или поглощается при растворении определенного количества неизвестной соли;
– количество теплоты, которое выделяется или поглощается при растворении определенного количества неизвестной соли;  – изменение температуры при растворении данной навески неизвестной соли. Рассчитав по уравнению количество теплоты
– изменение температуры при растворении данной навески неизвестной соли. Рассчитав по уравнению количество теплоты  , можно определить удельную теплоту растворения неизвестной соли:
, можно определить удельную теплоту растворения неизвестной соли:
 (11)
(11)
где  – величина навески неизвестной соли, г.
– величина навески неизвестной соли, г.
Для того, чтобы определить какая соль была взята в качестве неизвестной, полученную удельную теплоту растворения нужно преобразовать в интегральную теплоту растворения  и сравнить её со справочной величиной.
и сравнить её со справочной величиной.
Экспериментальная часть
Экспериментальные данные:
| Опыт с известной солью | Опыт с неизвестной солью | ||
| Соль _________ | Масса соли =______ Масса воды =______ | Соль №_____4____ | Масса соли =__2г____ Масса воды =__100мл____ |
| Время, мин | Температура, ºС | Время, сек | Температура, ºС |
| 0.000E+00 | 2.400E+01 | ||
| 3.000E+01 | 2.401E+01 | ||
| 6.000E+01 | 2.400E+01 | ||
| 9.000E+01 | 2.400E+01 | ||
| 1.200E+02 | 2.401E+01 | ||
| 1.500E+02 | 2.401E+01 | ||
| 1.800E+02 | 2.401E+01 | ||
| 2.100E+02 | 2.401E+01 | ||
| 2.400E+02 | 2.401E+01 | ||
| 2.700E+02 | 2.401E+01 | ||
| 3.000E+02 | 2.401E+01 | ||
| 3.300E+02 | 2.401E+01 | ||
| 3.600E+02 | 2.402E+01 | ||
| 3.900E+02 | 2.402E+01 | ||
| 4.200E+02 | 2.308E+01 | ||
| 4.500E+02 | 2.206E+01 | ||
| 4.800E+02 | 2.183E+01 | ||
| 5.100E+02 | 2.183E+01 | ||
| 5.400E+02 | 2.196E+01 | ||
| 5.700E+02 | 2.205E+01 | ||
| 6.000E+02 | 2.212E+01 | ||
| 6.300E+02 | 2.218E+01 | ||
| 6.600E+02 | 2.224E+01 | ||
| 6.900E+02 | 2.230E+01 | ||
| 7.200E+02 | 2.234E+01 | ||
| 7.500E+02 | 2.239E+01 | ||
| 7.800E+02 | 2.242E+01 | ||
| 8.100E+02 | 2.246E+01 | ||
| 8.400E+02 | 2.249E+01 | ||
| 8.700E+02 | 2.252E+01 | ||
| 9.000E+02 | 2.255E+01 | ||
| 9.300E+02 | 2.258E+01 | ||
| 9.600E+02 | 2.261E+01 |
Обработка результатов:
1. Построение графической зависимости ______________________
(для известной соли __________)
Определение изменения температуры Δt _1,000__________
2. Построение графической зависимости ______________________
(для неизвестной соли __________)

Определение изменения температуры Δt ____1,855_______
3. Расчёт теплоты растворения:
1) определение количества молей известной соли:
_______________________________________________________________
________________________________________________[ ]
2) расчет моляльной концентрации известной соли в растворе:
_______________________________________________________________
__________________________________________________[ ]
3) интегральная теплота растворения известной соли (из справочных данных) ______________ [ ]
4) расчет теплоты растворения известной соли:_____________________
_____________________________________________________________
_______________________________________________ [ ]
5) расчет постоянной калориметра:________________________________
_______________________________________________________________
6) расчет теплоты растворения неизвестной соли:_____________________
_________________________________________________ [ ]____
7) расчет удельной теплоты растворения неизвестной соли: ____________
_____________________________________________________________________________________________________________________[ ]
8) расчет интегральной теплоты растворения неизвестной соли (________)
___________________________________________________________________________________________________________________ _[ ]
Расчёт интегральной теплоты растворения на основе справочных данных для неизвестной соли (_____________)
1. определение количества молей исследуемой соли:
_______________________________________________________________
________________________________________________[ ]
2. расчет моляльной концентрации исследуемой соли в растворе:
_______________________________________________________________
__________________________________________________[ ]
3. интегральная теплота растворения исследуемой соли (из справочных данных) ______________ [ ]
Интегральная теплота растворения исследуемой соли ____________
| Экспериментальные данные | Справочные данные |
Расчёт относительной погрешности определения теплоты растворения неизвестной соли:
Выводы:
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________