1. теория Аррениуса.
- Соли, кислоты и основания при растворении в воде и некоторых других полярных растворителях диссоциируют на ионы.
- Ионы существуют в растворе независимо от того, проходит через раствор электрический ток или нет. Вследствие этого число независимо движущихся частиц растворенного вещества больше, чем при отсутствии диссоциации, и коллигативные свойства электролитов возрастают в i раз.
- Процесс диссоциации описывается законом действующих масс (протекает обратимо)
Недостатки:
Аррениус предполагал, что взаимодействие ионов в растворе не влияет на их распределение и движение, которые остаются хаотическими, как и в смесях идеальных газов.
Аррениус утверждал, что свойства отдельных ионов не зависят от концентрации, а некоторые свойства раствора в целом, например, электропроводность, пропорциональны числу ионов. Согласно этим представлениям подвижность ионов не должна зависеть от концентрации раствора, а электропроводность сильного электролита должна возрастать с увеличением концентрации раствора. Это противоречит экспериментальным данным.
По теории Аррениуса при m = 0,01 – 0,1 степень диссоциации сильных электролитов α = 0,75 – 0,95. Вычисляемые отсюда КД зависят от концентрации, то есть не являются константами. В действительности степень диссоциации сильных электролитов α→1, причем они диссоциируют необратимо. Экспериментально установлено, что недиссоциированных молекул в растворах сильных электролитов нет. Таким образом, теория Аррениуса не предусматривала деление электролитов на сильные и слабые.
Вывод: Классическая теория Аррениуса применима к слабым электролитам (α ≤ 0,05).
2. теория Бренстеда-Лоури
Теория электролитической диссоциации Аррениуса пригодна лишь для водных растворов, однако при переходе к неводным растворителям она оказалась несостоятельной. Например, NH4Cl, ведущий себя как соль в водном растворе, при растворении в жидком аммиаке проявляет свойства кислоты, растворяя металлы с выделением водорода:
2NH4Cl + Ca  2NH3 + CaCl2 + H2
2NH3 + CaCl2 + H2
Если по теории С.Аррениуса кислоты диссоциируют с образованием ионов водорода Н+, а основания- с образованием гидроксид-ионов ОН−, то согласно протолитической теории Бренстеда-Лоури: кислоты - это вещества, которые отщепляют протон Н+, а основания - присоединяют протон Н+.

Кислота – ион аммония, аммиак – сопряженное основание, если реакция будет протекать в обратном направлении, то аммиак будет основанием, а ион аммония – сопряженной кислотой.

Соляная кислота и вода – кислоты, гидроксид- и хлорид-ионы – основания.
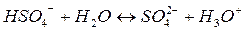
Гидросульфат-ион и ион гидроксония – кислоты, вода и сульфат-ион – основания.
Обращаю ваше внимание на то, что в реации с соляной килотой вода была основанием, а в реакции с гидросульфат-ионом – кислотой. Вещества, способные проявлять как свойства кислот, так и оснований получили название – амфолиты.
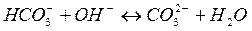 - проявляет кислотные свойства
- проявляет кислотные свойства
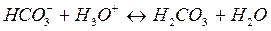 - проявляет свойства основания
- проявляет свойства основания
3. теория Льюиса – электронная теория, согласно которой кислотой называют частицу, способную присоединять электронную пару (акцептор электронов); Основанием называют частицу, способную отдавать электронную пару (донор электронов). Согласно представлениям Льюиса, кислота и основание взаимодействуют друг с другом с образованием донорно-акцепторной связи.

Ион серебра – кислота, аммиак – основание.
Реакция между нейтральными молекулами:
(СН3)3N: + ВF3 ⇔ (CH3)3N:ВF3
Триметилазот – основание, фторид бора – кислота.
Реакция нейтрализации в теории Льюиса рассматривается как присоединение электронной пары гидроксид-иона к иону водорода, предоставляющему для размещения этой пары свободную орбиталь: Н+ +: ОН− = Н:ОН.
Таким образом, ион водорода – кислота, гидрокид-ион – основание.
К основаниям Льюиса относят галогенид-ионы, аммиак, амины, кислородсодержащие органические соединения типа R2CO. К кислотам Льюиса относят галогениды бора, алюминия, кремния, олова.
Гидролиз – процесс обменного взаимодействия ионов соли с водой, приводящий к образованию малодиссоциированных веществ и сопровождающийся изменением реакции (pH) среды. Реакция братная нейтрализации.
Суть гидролиза солей заключается в том, что происходит смещение равновесия диссоциации воды вследствие связывания одного из ее ионов с образованием малодиссоциированного или труднорастворимого вещества. В большинстве случаев гидролиз является обратимым процессом. При повышении температуры и разбавлении гидролиз усиливается.
а) Соль образована слабой кислотой и сильным основанием (K2S).
При растворении в воде K2S диссоциирует
K2S  2K+ + S2-.
2K+ + S2-.
Ступенчатые реакции, выражения для констант по ступеням.
Избыток ионов OH– в растворе обусловливает щелочную реакцию среды в растворе (pН>7).
б) Cоль образована слабым основанием и сильной кислотой (CuCl2).
При растворении в воде CuCl2 диссоциирует
СuCl2  Cu2+ + 2Cl–
Cu2+ + 2Cl–
Ступенчатые реакции, выражения для констант по ступеням.
Таким образом, гидролиз соли, образованной слабым основанием и сильной кислотой (в данном случае CuCl2) протекает по катиону соли. Избыток ионов H+ в растворе обусловливает кислую реакцию среды в растворе (рН<7).
в) Соль образована слабой кислотой и слабым основанием (CH3COONH4).
CH3COO– + NH4+ + H2O  CH3COOH + NH4OH.
CH3COOH + NH4OH.
В этом случае образуются два малодиссоциированных соединения, и pH раствора зависит от относительной силы кислоты и основания. Если продукты гидролиза могут удаляться из раствора, то гидролиз протекает до конца. Например
Al2S3 + 6 H2O = 2Al(OH)3↓ + 3H2S.
Возможны и другие случаи необратимого гидролиза, их нетрудно предсказать, ведь для необратимости процесса небходимо, чтобы хотя бы один из продуктов гидролиза уходил из сферы реакции.
г) Соли, образованные сильной кислотой и сильным основанием (NaCl, K2SO4, RbBr и др.) гидролизу не подвергаются, т.к. единственным малодиссоциирующим соединением является H2O (рН=7). Растворы этих солей имеют нейтральную среду. Например
NaCl + H2O  NaOH + HCl
NaOH + HCl
Na+ + Cl– + H2O  Na+ + OH– + H+ + Cl–
Na+ + OH– + H+ + Cl–
H2O  H+ + OH–.
H+ + OH–.
Реакции обратимого гидролиза полностью подчиняются Ле-Шателье. Поэтому гидролиз соли можно усилить (и даже сделать необратимым) следующими способами:
1) добавить воды;
2) нагреть раствор, при этом усиливается эндотермическая диссоциация воды, а значит, увеличивается количество ионов Н+ и ОН–, которые необходимы для осуществления гидролиза соли;
3) связать один из продуктов гидролиза в труднорастворимое соединение или удалить один из продуктов в газовую фазу; например, гидролиз цианида аммония NH4CN будет значительно усиливаться за счет разложения гидрата аммиака с образованием аммиака NH3 и воды:
NH4+ + CN– + H2O  NH3 + H2O +HCN.
NH3 + H2O +HCN.
Гидролиз можно подавить, действуя следующим образом:
1) увеличить концентрацию растворенного вещества;
2) охладить раствор (для ослабления гидролиза растворы солей следует хранить концентрированными и при низких температурах);
3) ввести в раствор один из продуктов гидролиза; например, подкислять раствор, если его среда в результате гидролиза кислая, или подщелачивать, если щелочная.
Взаимное усиление гидролиза Допустим, что в разных сосудах установились равновесия
CO32– + H2O  HCO3– + OH–
HCO3– + OH–
Al3+ + H2O  AlOH2+ + H+
AlOH2+ + H+
Обе соли гидролизованы незначительно, но если растворы смешать, то происходит связывание ионов H+ и OH–. В соответствии с принципом Ле-Шателье оба равновесия смещаются вправо, гидролиз усиливается и протекает полностью
2 AlCl3 + 3 Na2CO3 + 3 H2O = 2 Al(OH)3↓ + 3 CO2 + 6 NaCl.
Это называется взаимным усилением гидролиза. Таким образом, если смешивать растворы солей, из которых одна гидролизуется по катиону, а другая – по аниону, гидролиз усиливается и протекает полностью.