ЗАНЯТИЕ № 9 (Практическое занятие)
Тема: ФЕРМЕНТЫМИКРООРГАНИЗМОВ. ИДЕНТИФИКАЦИЯ ЧИСТОЙ КУЛЬТУРЫПО БИОХИМИЧЕСКИМ СВОЙСТВАМ.
Цель занятия: изучить ферментативные (сахаролитические и протеолитические, гемолитические и редуцирующие) свойства микробов и другие методы обязательные для идентификации возбудителя; продолжить выделение чистой культуры аэробов и анаэробов (3 и 4 день)
Вопросы для обсуждения
1. Ферменты микроорганизмов. Классы ферментов.
2. Секреция продуктов жизнедеятельности микробной клетки: пигменты, аромат, газообразование, светящиеся микроорганизмы, микробные токсины.
3. Идентификация бактерий по биохимическим свойствам: сахаролитические, протеолитические, гемолитические, липолитические свойства. Редуцирующие (окислительно-восстановительные) свойства микробов.
4. Современные методы биохимической идентификации бактерий.
5. Выделение чистой культуры (3-4 дни: аэробы; 3-5 дни: анаэробы).
Оформление протокола практического занятия (сделать дома)
1) Проверить записи по самостоятельной работе, выполненной на занятиях № 7 и 8. Сделать описание хода и результатов самостоятельной работы (первый день микробиологического исследования:…; второй день микробиологического исследования:…)!!!
2) Оформить демонстрационные материалы «Методы культивирования анаэробов» - кратко описать методику + картинка метода или его фото (с занятия)
3) Записать понятия и зарисовать примеры определения следующих свойств:
- сахаролитических свойств на жидких средах Гисса (рис 9.1) и среде Олькеницкого (рис 9.3) (какие свойства и по изменению какой части среды определяются на среде Олькеницкого);
- протеолитических свойств – определение образования индола, сероводорода и аммиака, и формы разжижения желатина (рис 9.4 и 9.5);
- гемолитические свойства;
- липолитические свойства;
- редуцирующие свойства;
- окислительно-восстановительные свойства;
3) Подготовить Таблицу 9.1. для заполнения на занятии.
Задания для выполнения практической работы
1. По демонстрационным препаратам:
- определить сахаролитические и протеолитические ферменты микробов кишечной группы при посеве на «пестрый» ряд и МПБ с индикаторами;
- определить способность микроорганизмов вырабатывать ферменты: каталазу, оксидазу, плазмокоагулазу, гиалуронидазу;
- заполнить таблицу 9.1
2. Сделать фото всех демонстрационных препаратов для оформления в протокол самостоятельной работы.
МАТЕРИАЛ К ИЗУЧЕНИЮ.
Ферменты микробов. Ферменты состоят из белковой (апофермент) и небелковой частей (простетическая группа). Простетическая группа обеспечивает специфичность действия каждому ферменту, поэтому он взаимодействует только с одним субстратом.
Ферменты классифицируются:
а) по характеру вызываемых превращений: гидролазы, оксидоредуктазы, трансферазы, лиазы, изомеразы, лигазы;
б) по локализации и месту действия: эндо- и экзоферменты;
в) по времени образования: конститутивные, индуцибельные;
г) по расщепляемому субстрату: сахаролитические, протеолитические, липолитические.
При биохимической дифференциации микробов определяют их свойства:
1 - сахаролитические – способность сбраживать углеводы и многоатомные спирты с образованием кислоты и газа или только кислоты;
2 - протеолитические – способность разлагать белковые продукты с образованием сероводорода, индола и других веществ;
3- гемолитические – способность лизировать эритроциты на кровяном агаре (КА) или на бульоне с отмытыми эритроцитами;
4 - редуцирующие – способность восстанавливать некоторые химические вещества (краски и др.).
Сахаролитические свойства микробов определяют путем посева чистой культуры на специальные дифференциально-диагностические питательные среды, содержащие различные углеводы (лактозу, сахарозу, глюкозу, мальтозу, маннит и др.) и индикатор (реактив Андреде или др.). Наиболее распространенной является среда Гисса, которая представляет собой смесь сахара и индикатора в пептонной воде. Для улавливания газа на дно пробирки со средой опускают «газовки» – поплавки для улавливания газа. Образовавшийся в процессе ферментации газ вытесняет часть среды и скапливается вверху «газовки». Под действием образующейся при расщеплении углевода кислоты индикатор изменяет окраску среды. Поэтому эти среды названы «пестрый ряд». Короткий "пестрый ряд" включает жидкие среды Гисса с моно- и дисахаридами: глюкозой, лактозой, сахарозой, мальтозой и с 6-атомным спиртом – маннитом. В длинный "пестрый ряд" наряду с перечисленными углеводами вводят среды с разнообразными моносахаридами (арабиноза, ксилоза, рамноза, галактоза и др.) и спиртами (глицерин, дульцит, инозит и др.).
Методика определения сахаролитических свойств. Культуру микроорганизмов высевают на жидкие среды Гисса с поплавками (5 пробирок с глюкозой, лактозой, сахарозой, мальтозой и маннитом). Помещают в термостат при температуре 37оС на 24 часа. Определяют в каждой пробирке происшедшие изменения, указывают наличие кислотообразования буквой «К», что видно по покраснению среды, и газообразования буквой «Г», в том случае, если поплавок заполнен газом.
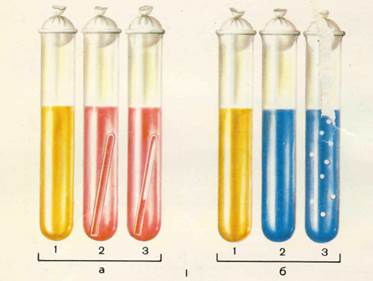
Рис. 9.1. Изучение сахаролитической активности микроорганизмов.
I – «пестрый ряд»: а – жидкая среда с углеводами и индикатором Андреде; б – полужидкая среда с индикатором ВР: 1 – микроорганизмы не ферментируют углевод; 2 – микроорганизмы ферментируют углевод с образованием кислоты; 3 – микроорганизмы ферментируют углевод с образованием кислоты и газа.
Кроме того, сахаролитическую активность изучают на средах Эндо, Левина, Плоскирева. Микроорганизмы, сбраживая до кислоты находящийся в этих средах молочный сахар (лактозу), образуют окрашенные колонии — кислота изменяет цвет имеющегося в среде индикатора. Колонии микробов, не ферментирующих лактозу, бесцветны.


Рис.9.2. Рост энтнробактерий на среде Эндо: 1 – лактозонегативные; 2 – лактозопозитивные.
Рис 9.3. Рост на трехсахарном железосодержащем агаре (среде Олькеницкого):
1. Контроль (незасеянная среда)
2. род Proteus3. род Escherichia
4. род Shigella
5. род Salmonella
Молоко при росте микробов, сбраживающих лактозу, свертывается.
При росте микроорганизмов, образующих амилазу, на средах с растворимым крахмалом происходит его расщепление. Об этом узнают, прибавив к культуре несколько капель раствора Люголя — цвет среды не изменяется. Нерасщепленный крахмал дает с этим раствором синее окрашивание.
Определение протеолитических свойств микробов проводят на средах с желатином, молоком, сывороткой, пептоном.
Пептон – промежуточный продукт распада белков, представляет собой смесь полипептидов и аминокислот. Хорошо растворяется в воде и не свертывается при нагревании. Получают пептон из рубцов крупного и мелкого рогатого скота.
Желатин – животный клей, состоящий из белка сухожилий, костей, хрящей. Светло-коричневого цвета, без запаха и вкуса. Плавится при температуре 32–34оС, застывает при температуре 16оС. При посеве уколом в столбик желатиновой среды микробы, разлагающие желатин, разжижают среду.
Действие микроорганизмов, разлагающих казеин (молочный белок), проявляется в пептонизации молока, которое приобретает вид молочной сыворотки.
В процессе ферментации пептонов микроорганизмы образуют индол (С8Н7N), сероводород (Н2S), аммиак (NH3) и другие соединения.
 Рис. 9.4. Определение протеолитических свойств бактерий - формы разжижения желатина: 1- в форме гвоздя; 2- в форме чашечки; 3 – воронкообразное; 4 – в форме треугольника; 5 – послойное; 6 – мешкообразное.
Рис. 9.4. Определение протеолитических свойств бактерий - формы разжижения желатина: 1- в форме гвоздя; 2- в форме чашечки; 3 – воронкообразное; 4 – в форме треугольника; 5 – послойное; 6 – мешкообразное.
Методика определения сероводорода. Над культурой исследуемых микробов помещают полоску фильтровальной бумаги, смоченную раствором уксуснокислого свинца или сульфатом железа (бумага закрепляется между пробкой и стенкой пробирки). Пробирки помещают до трех суток в термостат. Почернение бумаги происходит при выделении сероводорода, который превращает уксуснокислый свинец в сернокислый или в нерастворимый сульфид железа. Продукцию сероводорода можно определить также путем посева исследуемой культуры микробов уколом в столбик с питательной средой, содержащей различные соли (сульфат железа, тиосульфат натрия, сульфит натрия). При образовании Н2S среда окрашивается в черный цвет за счет образования сульфида железа (FeS).
Методика определения индола. Определение индола по методу Морелли осуществляют с помощью полоски фильтровальной бумаги, обработанной горячим насыщенным 12 % водным раствором щавелевой кислоты и высушенной в термостате. Бумагу закрепляют между пробкой и стенкой пробирки. Пробирки с исследуемой культурой помещают в термостат на трое суток. Порозовение нижней части индикаторной бумаги указывает на наличие индола. Также индол можно определить по методу Эрлиха. Для этого в пробирку с исследуемой культурой микробов добавляют 2-3 мл эрифа, энергично перемешивают и прибавляют несколько капель реактива Эрлиха (спиртовой раствор параметиламидобензальдегид с хлористоводородной кислотой). При наличии индола наблюдается розовое окрашивание или розовое кольцо.
Методика определения аммиака. Над культурой исследуемых микробов помещают полоску увлажненной красной лакмусовой бумаги (бумага закрепляется между пробкой и стенкой пробирки). Пробирки помещают в термостат. В присутствии аммиака бумага синеет.
В бактериологической практике иногда ограничиваются изучением сахаролитических и протеолитических свойств исследуемых бактерий, если этого достаточно для их идентификации.

Рис 9.5. Определение протеолитических свойств бактерий: II – определение сероводорода; III - определение индола; IV – определение аммиака. 1- контроль, 2 - положительный результат.
Редуцирующие свойства микробов. Редукцией или восстановлением того или иного вещества называется химический процесс, состоящий в отнятии кислорода от данного вещества или замене его водородом. Имеются вещества, которые при редукции легко обесцвечиваются.
 Тест на оксидаза - используются для дифференциации представителей родов Neisseria, Alcaligenes, Aeromonas, Vibrio, Campylobacter и Pseudomonas (обладают оксидазной активностью) от энтеробактерий (оксидазоотрицательные). Для постановки этого теста, например, используется флакончик, в котором находятся стерильные диски из фильтровальной бумаги, пропитанные оксалатом N,N-диметил-парафенилендиамина, аскорбиновой кислотой и a -нафтолом.
Тест на оксидаза - используются для дифференциации представителей родов Neisseria, Alcaligenes, Aeromonas, Vibrio, Campylobacter и Pseudomonas (обладают оксидазной активностью) от энтеробактерий (оксидазоотрицательные). Для постановки этого теста, например, используется флакончик, в котором находятся стерильные диски из фильтровальной бумаги, пропитанные оксалатом N,N-диметил-парафенилендиамина, аскорбиновой кислотой и a -нафтолом.
Для осуществления дыхания (биологического окисления с целью получения энергии) у некоторых бактерий имеется цитохромоксидаза, либо индофенолоксидаза – железосодержащий белок, гемопротеин, который катализирует перенос электронов от вещества-донора (например, НАД-Н) к веществам-реципиентам (обычно О2). Бесцветный N,N-диметил-парафенилендиамин служит искусственным реципиентом электронов. В ходе оксидазного теста из него в результате окислительно-восстановительных реакций с участием микробной оксидазы образуется индофенол – вещество синего цвета. В случае положительной реакции (наличие цитохромоксидазы) из оксалата N,N-диметил-парафенилендиамина и a -нафтола образуется синий индофенол.
Оксидазный тест проводят путем снятия микробной колонии и растирания ее по оксидазному диску. Учет реакции ведут в течение 5–10 секунд при 25–30°С. Замедленные положительные реакции появляются через 10–60 секунд. Отсутствие изменения цвета на диске или развитие окраски через 60 и более секунд расценивают, как отрицательную реакцию.
Важным признаком у микробов является способность к образованию фермента каталазы. Для ее обнаружения на предметное стекло наносят каплю 1-3% раствора перекиси водорода и в нее вносят бактериологической петлей исследуемую культуру микробов. При положительном результате наблюдают выделение пузырьков газа в результате разложения Н2О2 на кислород и воду.
При необходимости исследуют другие признаки, например способность восстанавливать нитраты в нитриты, карбоксилировать аминокилоты, образовывать оксидазу, плазмокоагулазу, фибринолизин и другие ферменты.
Ряд ферментов (нейраминидаза, гиалуронидаза, коагулаза и др.) способствуют проявлению патогенных свойств у возбудителей некоторых инфекционных заболеваний, поскольку субстратом их действия являются вещества, входящие в состав клеток и тканей организма человека.
Плазмокоагулаза — выявляется в пробирочном опыте путем определения скорости свертывания испытуемым микробом цитратной кроличьей или человеческой плазмы.


Коагулазний тест «+» Staphylococcus aureus Коагулазний тест «-» Staphylococcus epidermidis
Гемотоксин — вызывает лизис эритроцитов. Определяется при посеве испытуемых микробов на кровяной агар. Вокруг колонии наблюдается зона просветления среды.


Лецитиназа — разрушает лецитовителлин яичного желтка. Обнаруживается при посеве испытуемых микробов на желточно-солевой агар (ЖСА) по образованию вокруг колоний зоны помутнения с радужным венчиком.


Гиалуронидаза — расщепляет гиалуроновую кислоту, входящую в состав соединительной ткани. В пробирку с испытуемой культурой вносится гиалуроновая кислота и после 30-минутной экспозиции при 37 °С добавляется 2 капли крепкой уксусной кислоты. При наличии фермента гиалуроновая кислота утрачивает способность образовывать сгусток.
Фибринолизин — растворяет фибрин плазмы крови, добавленной к питательной среде.
(Черкес Ф.К., Богоявленская Л.Б., Бельская Н.А. 'Микробиология' - Москва: Медицина, 1986 - с.512 - https://biologylib.ru/books/item/f00/s00/z0000015/st007.shtml - все рассказано очень доступно)
Современные методы биохимической идентификации бактерий
Для ускоренной идентификации выделенных чистых культур применяются наборы коммерческих тест-систем. Они позволяют быстро и надежно определить ферментативные свойства микроорганизмов. Тест-системы представляют собой наборы микропробирок или микроконтейнеров с определенными субстратами, дисками или полосками бумаги, пропитанными различными ингредиентами, наборы индикаторных карандашей и др. Такие системы значительно сокращает время анализа. Ниже приводятся некоторые из наиболее часто используемых в практике микробиологических исследований микросистем.
1. Система «Enterotub» позволяет определить 9 признаков (сбраживание лактозы, глюкозы, дульцита, образование индола и сероводорода, утилизация цитрата, мочевины, фенилаланина, декарбоксилирование лизина). Система представляет собой пластиковую трубку, разделенную на 8 камер с питательными средами, содержащими индикаторы. Посевным материалом является изолированная колония бактерий с чашки первичного посева.
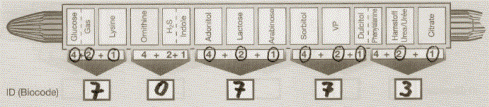
2. Система АР1-20Е — пластиковая полоска с 20 микроконтейнерами, в которых имеется набор сухих индикаторных питательных сред. В их составе дифференцирующие аминокислоты, углеводы, желатин, мочевина, реактивы на сероводород, индол, ацетоин и др.

3. Система Micro Id включает 15 биохимических тестов для дифференциации бактерий семейства Enterobacteriaceae и представляет собой набор бумажных индикаторных дисков,размещенных в лунках пластикового лотка.
4. Набор Patho Tec Rapid ID состоит из бумажных полосок, снабженных индикаторными поясками для выявления ферментов или конечных продуктов обмена веществ. Этот набор позволяет определить до 10 признаков в течение 1-4 ч.
5.  Системы индикаторные бумажные (СИБ) используются для ускоренной диагностики энтеробактерий и холерных вибрионов. Это диски или полоски бумаги, пропитанные различными субстратами (углеводами, аминокислотами) и индикаторами. Наша промышленность выпускает несколько таких систем разного целевого назначения. Например, набор № 2А (малый) включает 9 тестов и предназначен для межвидовой дифференциации энтеробактерий. Набор № 2Б (расширенный) состоит из 25 субстратов с индикаторами для видовой дифференциации энтеробактерий.
Системы индикаторные бумажные (СИБ) используются для ускоренной диагностики энтеробактерий и холерных вибрионов. Это диски или полоски бумаги, пропитанные различными субстратами (углеводами, аминокислотами) и индикаторами. Наша промышленность выпускает несколько таких систем разного целевого назначения. Например, набор № 2А (малый) включает 9 тестов и предназначен для межвидовой дифференциации энтеробактерий. Набор № 2Б (расширенный) состоит из 25 субстратов с индикаторами для видовой дифференциации энтеробактерий.
Таблица 9.1