Модели строения атома.
Томсон (открыл электрон): положительный заряд атома занимает весь его объем и распределен с постоянной плотностью. Простейший атом - атом водорода: представляет собой положительно заряженную сферу, внутри которой находится е-. В невозбужденном атоме е- покоится в центре сферы. У более сложных атомов в положительно заряженной сфере находится несколько е-, так что атом подобен кексу, изюм – е-. Модель не объясняет излучение большого числа спектральных линий и не позволяет объяснить спектральные закономерности, найденные эмпирически,не дает возможности понять, что определяет размеры атомов, в полном противоречии с опытами по исследованию распределения положительного заряда в атоме.
Резерфорда: планетарная модель атома. В центре ядра расположено положительно заряженное атомное ядро, в котором сосредоточена почти вся масса атома. В целом атом нейтрален. Поэтому число внутриатомных е-, как и заряд ядра, равно порядковому номеру элемента в период. сис-ме. е- дв-ся вокруг ядра, как планеты обращаются вокруг Солнца. Хар-р движения электронов опр-ся действием кулоновских сил со стороны ядра. В атоме водорода вокруг ядра обращается всего лишь один электрон. Его ядро имеет положительный заряд, равный по модулю заряду электрона, и массу, примерно в 1836,1 раза большую массы электрона. Это ядро было названо протоном и стало рассматриваться как элементарная частица. Размер атома - это радиус орбиты его электрона. Планетарная модель атома имеет прямое экспериментальное обоснование. Но нельзя объяснить факт сущ-ия атома, его устойчивость. Ведь движение е- по орбитам происходит сбольшим ускорением. Ускоренно движущийся е- по законам электродинамики должен терять энергию и приближаться к ядру. Как показывают строгие расчеты, основанные на механике Ньютона и электродинамике Максвелла, электрон за ничтожное время должен упасть на ядро. Атом должен прекратить свое существование.
Бор и его постулаты. Основываясь на разрозненных опытных фактах, Бор с помощью интуиции предугадал существо дела. Он в виде постулатов сформулировал основные положения новой теории. Причем законы классической физики не отвергались им безоговорочно. Постулаты налагали лишь некоторые ограничения. Его теория впоследствии привела к созданию стройной теории движения микрочастиц - квантовой механики. 1) атомная сис-ма может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соот-ет опр-ая энергия E. В стационарном состоянии атом не излучает. 2) излучение света происходит при переходе атома из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией. Энергия излученного фотона равна разности энергий стационарных состояний. При поглощении света атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией.
Современная модель атома. Ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Положение атома втаблице Менделеева определяется электрическим зарядом его ядра (то есть кол-вом протонов), в то время как кол-во нейтронов принципиально не влияет на хим свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то кол-во электронов в нём равно кол-ву протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).Массу атома принято измерять в атомных единицах массы, равных 1/12 от массы атома стабильного изотопа углерода 12C.
Волновая функц, или пси-функц 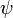 — комплекснозначная функц, используемая в квантовой механике для описания чистого состояния сист-мы.
— комплекснозначная функц, используемая в квантовой механике для описания чистого состояния сист-мы.
Математически положение электрона-волны в атоме описывается ур-ем Шрдингера, или так называемой пси-функцией. В простейшем случае это волновое уравнение имеет вид: 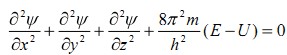 , где U - потенциальная энергия частицы; E – еѐ полная энергия; X, Y, Z - координаты частицы;
, где U - потенциальная энергия частицы; E – еѐ полная энергия; X, Y, Z - координаты частицы; 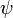 - пси-функц; h - постоянная Планка
- пси-функц; h - постоянная Планка
Квадрат модуля пси-функции 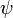 2 опр-ет вероятность обнаружения е- в данной точке пространства в определенное время. Решая ур-ие Шредингера находят главное квантовое число n, хар-щее те орбиты, нахождение на которых е- любого атома периодической сист-мы наиболее вероятно.
2 опр-ет вероятность обнаружения е- в данной точке пространства в определенное время. Решая ур-ие Шредингера находят главное квантовое число n, хар-щее те орбиты, нахождение на которых е- любого атома периодической сист-мы наиболее вероятно.
Главное квантовое число n опр-ет эн-ю электрона на той или иной орбите, или энергет.уровне. Значение n для электронов в каком-либо атоме можно найти, определив квадрат модуля пси-функции. Вычислить эн-ю е- на опр-ом энергет.уровне можно по следующему соотн-ию, которое вытекает из квантовой теории: 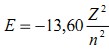 где Z – заряд ядра атома; n – номер энергетического уровня.
где Z – заряд ядра атома; n – номер энергетического уровня.
Знак «- » показывает, что отрыв е- требует затраты эн-и. она выр-ся в электрон-вольтах. Один электрон-вольт – это энергия, необходимая для отрыва от атома первого электрона. Она зависит от расстояния его до ядра (чем ближе к ядру находится электрон, тем меньше его эн-я). Поэтому говорят, что главное квантовое число опр-ет положение е- на том или ином энергет. уровне (или квантовом слое).
Орбитальное квантовое число —число ℓ, опр-ее азимутальное распределение амплитуды волновой функцииэлектрона в атоме, то есть форму электронного облака. Определяет подуровень энергетического уровня
Магнитное квантовое число ml определяет ориентацию электронного облака в пространстве.
Спиновое квантовое числом ms (спин – «вращение» или «веретено»).Очень упрощенно спин можно считать вращением электронного облака вокруг своей оси по часовой стрелке или в противоположном направлении. Может принимать значения +1/2 и -1/2. Полож-ое и отриц-ое знач-ие опр-ют противоположные направления спина. е- с одинаковыми направление спина – параллельными (с параллельным спином), а противоположное – антипараллельными.
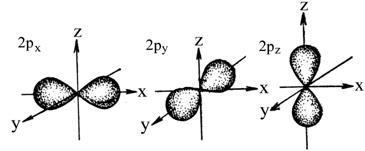
Электронные орбитали – энергет. уровни, на которых вращаются е-. Есть S подуровень.Он имеет сферическую форму(шарика). Она самая устойчивая и располагается довольно близко к ядру.Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания и наконец превращается в гантелеобразную p -орбиталь. Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z. Это легко объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака взаимно отталкиваются и стремятся разместиться как можно дальше друг от друга. Все вместе три электронных облака, которые называют px-, py- или pz-орбиталями, образуют симметричную геометрическую фигуру, в центре которой находится атомное ядро. Она похожа на шестиконечный помпончик или на тройной бант - кому как нравится. Итак, p-орбиталей может быть три. Энергия их, конечно, одинакова, а расположение в пространстве - разное. d и f орбитали: попадающие е- приобретают еще больший запас эн-и, двигаются по сложным путям, и в итоге получаются сложные и красивые объемные геометрические фигуры.
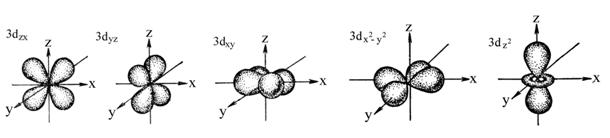
Все d-орбитали (а их может быть уже пять) одинаковы по энергии, но по-разному расположены в пространстве. Да и по форме, напоминающей перевязанную лентами подушечку, одинаковы только 4. 5ая- вроде гантели, продетой в бублик.
Принцип Паули: в атоме не может быть двух электронов, имеющих одинаковый набор всех четырех квантовых чисел.
Макс. кол-во е- на энергет.уровне опр-ся по формуле N = 2n2, где N – число электронов, а n – номер энергетического уровня. Номер группы химического элемента в табл эл-в соответствует кол-ву е- на его внешнем энергет.уровне.
Правило Гунда: в подуровне (p, d или f) е- стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальным.
Правило Клечковского: заполнение энергетических уровней происходит в порядке возрастания суммы квантовых чисел n+l, а при их равенстве в порядке возрастания n, или в следующем порядке: 1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p< 6s<5d1<4f<5d<6p<7s<6d2<5f<6d<7p
Периодический закон Менделеева – фундаментальный закон природы. 1869:"Свойства элементов, а потому и образуемых ими прос и слож тел (вещ-в), стоят в периодической зависимости от их атомного веса". Современная формулировка:"свойства хим-их эл-в (т.е. свойства и форма образуемых ими соединений) находятся в период-ой зависимости от заряда ядра атомов хим-их эл-в".
Ряд – большие, малые, нижние, четные, нечетные
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы. Подгруппа, в которую входят эл-ы малых и больших периодов – главная. Подгруппа, в которой эл-ы больших периодов – побочная.
Период – ряд эл-в, расположенных в порядке возрастания их порядковых номеров, начиная щелочными Ме и заканчивая инертным газом. Номер периода обозначает число энергет. уровней в атоме эл-та. Период, содержащий 2 или 8 эл-в – мылых. В котором больше 8и эл-в – большой.
2 вид – разрушение водой, содержащей соли, способные вступать в обменные реакции с составляющими цементного камня. При этом образуются продукты, которые либо легкорастворимы, либо выделяются в воде аморфной массы, не обладающей связующими св-ми. В рез-те преобразований ↑ пористость цементного камня => ↓ его прочность.
3 вид - процессы, возникающие под действием сульфатов. В порах цементного камня происходит отложение малорастворимых вещ-в, содержащихся в воде, или продуктов взаимодействия их с составляющими цементного камня. Их накопление и кристаллизация в порах вызывают значительные растягивающие напряжения в стенках пор и приводит к разрушению цем. к. (Исключить или ослабить влияние коррозионных процессов при действии различных вод можно конструктивными мерами, путем улучшения технологии приготовления бетона и применения цементов определенного минералогического состава и необходимого содержания активных минеральных добавок)
Энергия ионизации — разновидность энергии связи(или первый ионизационный потенциал (I1)), представляет собой наименьшую эн-ю, необходимую для удаления е- от свободного атома в его низшем энергет состоянии на бесконечность. Явл-ся одной из главных хар-к атома, от нее значительно зависят природа и прочность образуемых атомом хим-их связей, сущ-но зависят восст-ные св-ва соответствующего простого вещ-ва. Для многоэлектронного атома сущ-ют также понятия второго, третьего и т. д. ионизационных потенциалов, представляющих собой энергию удаления электрона от его свободных невозбуждённых катионов с зарядами +1, +2 и т. д. Эти ионизационные потенциалы, как правило, менее важны для характеристики хим-ого элемента. [(Кдж)/моль(эВ)/атом]
Сродство атома к электрону (ε) – эн-ия, выделяющаяся в пр-се присоединения е- к свободному атому Э в его основном состоянии с превращением его в отриц. ион Э− (сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона).Э + e− = Э− + ε
Электроотрицательность – способ-ть атома данного эл-та к оттягиванию на себя электр. плотности по сравнению с др. эл-ми, входящими в соединение. Зависит от эн-и ионизации атома и его сродства к электрону (иногда ее считают равной полусумме того и другого). Большое значение имеет атомный радиус (атомы и ионы не имеют строго определенных границ вследствие волновой природы электрона, поэтому определяют условные радиусы атомов и ионов, связанных хим связью в кристаллах). Радиусы атомов в периодах с ростом порядкового номера уменьшаются, так как возрастает заряд ядра, а, следовательно, и притяжение к нему электронов. В пределах одной группы атомные радиусы возрастают, так как возрастает число энергетических уровней (электронных слоев)
Ковалентная связь (атомная связь, гомеополярная связь) — хим связь, образованная перекрытием (обобществлением) пары валентных электр. облаков. Обеспечивающие связь электронные облака (е-) – общая электр. пара. Хар-ые св-ва ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют хим и физические свойства соединений. Направленность связи обусловлена молекулярным строением вещ-ва и геометрической формы их молекулы. Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Полярность обусловлена неравномерным распределением электр. плотности вследствие различий в электроотрицательностях атомов,бывают: неполярные и полярные. Поляризуемость выр-ся в смещении е- связи под влиянием внешнего электр. поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам. Электроны тем подвижнее, чем дальше они находятся от ядер.
Ионная связь — прочная хим связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электр. пара полностью переходит к атому с большей электроотрицательностью. Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %. Ионная связь — крайний случай поляризации ков-ой полярной связи. Образуется между типичным Ме и НеМе. При этом е- у Ме полностью переходят к НеМе, образуются ионы.
Донорно-акцепторной связь – один из входящих в молекулу атомов имеет неподеленную электр. пару, а другой - свободную квантовую ячейку. Примером: образование положительно заряженного иона аммония NH4+, где донором является азот (в молекуле аммиака), а акцептором - катион водорода;
Металлическая связь – взаимод. Электр. газа (валентные электроны) в Ме с остовом положительно заряженных ионов кристаллич. решетки. Идеальная модель металлической связи отвечает образованию частично заполненных валентными электронами металла зон энергетич. уровней, наз. зонами проводимости. При сближении атомов, образующих Ме, атомные орбитали валентных е- переходят в орбитали, делокализованные по кристаллич. решетке аналогично делокализованным p-орбиталям сопряженных соединений. Кол-но описать метал-ую связь можно только в рамках квантовой механики, кач-но образование метал-ой связи можно понять исходя из представлений о ковалентной связи.
Межмолекулярные взаимодействия – взаимод. молекул между собой, не приводящее к разрыву или образованию новых хим. связей, опр-ет отличие реальных газов от идеальных, сущ-ие жидкостей и мол. кристаллов. От них зависят мн. структурные, спектральные, термодинамич., теплофиз. и др. св-ва вещ-в. Появление понятия связано с Ван-дер-Ваальсом, к-рый для объяснения св-в реальных газов и жидкостей предложил состояния, учитывающее межмолекулярное взаимодействие. Поэтому их силы часто называют ван-дер-ваальсовыми.
Виды.Основу межмолекулярного взаимодействия составляют кулоновские силы взаимод. между е- и ядрами одной молекулы и ядрами и е- другой. В экспериментально определяемых св-вах в-ва проявляется усредненное взаимод., к-рое зависит от расстояния R между молекулами, их взаимной ориентации, строения и физ. характеристик.
Окислительно-восстановительные процессы - биохим превращения, связанные с приобретением и потерей е-.
ОВР – реакции, протекающие с изменением степеней окисления атомов элементов, входящих в состав реагирующих вещ-в. Вост-ль – отдает электроны, повышая ст. окис. Окисл-ль – принимает электроны, снижая ст. окис.
2.Определение окислительно-восстановительных потенциалов
3. Биологические окислительно-восстановительные пары
Виды ОВР: 1)межмолекулярные – изменяются степени окисления атомов в разных по природе частицах СI2+Н2=2НСI. 2)внутримолекулярные – изменяются степени окисления разных атомов, входящих в состав одной и той же молекулы 2КСlO3=2KCl+3O2. 3)диспропорционирования (самоокисления – самовосстановления) – одновременное изменение степени окисл. одного и того же элемента 3Cl2+6KOH=5KCl+КСlO3+3H2O
Эквивалент окисл-ля(восст-ля) – реальная(условная) частица, соответствующая в данной реакции электрону.
Эквивалентная масса – отношение молярной массы вещ-ва к числу электронов, отданных или принятых в ходе данной реакции МЭ=  (г/моль)
(г/моль)
Электрохим. пр-сы - процессы взаимного превращения хим и электрической энергии в электрохим-их сис-мах происходят. Сущ-ет две группы: 1) процессы превращения хим энергии в электрическую (в гальванических элементах); и 2) процессы превращения электрической энергии в хим (электролиз).
Критерием самопроизвольности протекания электрохим реакции в электрохим-их сис-мах является отрицательное значение изменения энергии Гиббса ΔG
Гальванический элемент - хим-ий источник электрического тока. Принцип действия его основан на хим реакции двух металлов с электролитом, в результате которой выделяется электрический ток. ЭДС гальванического элемента зависит от вещ-в, из которых он состоит. Виды: 1) угольно-цинковые; 2)щелочные (р-р КОН); 3) никельоксигидроксидные; 4)литиевые.
Принцип работы гальван. эл-та: медно-цинковый (Якоби- Даниэля), цинковая и медная пластинки погружены в рас-р солей ZnSO4 и CuSO4, соединенных проводником. Полуэлементы связаны электр. Ключом или сообщаются через пористую перегородку. Работа обусловлена протеканием ОВР Zn+CuSO4= ZnSO4+Cu. Электрод из Zn(более активного Ме) посылает электроны во внешнюю цепь. Атомы Zn окисляются на ионы, цинковый электрод разрушается Zn(Т)= Zn(р-р)+2e-. Цинковый электрод, на котором происходит пр-с окис-я – анод.На медном электроде идет пр-с вост-я. Ионы меди, принимая e- из внешней цепи, восст-ся в атомы, которые осаждаются на электроде Cu+2e-=Cu(Т). Медный электрод – катод.Одновременно анионы SO4 из сосуда CuSO4 через пористую перегородку перемещаются в сосуд с ZnSO4. Электр. цепь становится замкнутой. Во внешней цепи возникает электр. ток, который можно измерить гальванометром. Краткая схема: 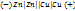
Причиной появления и протекания электр.тока в гальв.эл-х является разность потенциалов, возникающая на электродах, его электродвижущая сила ЭДС. ЭДС=Ек-Еа. должен быть >0.
Формула Нернста – уравнение, связывающее окислительно-восстановительный потенциал сист-мы с активностями вещ-в, входящих в электрохим-ое ур-ие, и стандартными электродными потенциалами окислительно-восстановительных пар. Е=Е0+ 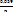 lgα, где n – число е-, участвующих в электродном пр-се; а – активность катионов металла в растворе. В разбавленных растворах активность можно заменить концией ионов [C] в моль/л.
lgα, где n – число е-, участвующих в электродном пр-се; а – активность катионов металла в растворе. В разбавленных растворах активность можно заменить концией ионов [C] в моль/л.
Явления на границе раздела фаз металл-электролит
Пр-ы электрохим. коррозиии протекают в водных р-рах. При соприкосновении метал-ой поверхности с р-ром электролита происходит взаимод-ие Ме с заряженными частицами р-ра и переход ионов Ме в р-р. Тогда протекают два сопряженных пр-са: 1) переход ионов из металла в раствор с образованием сольватированных (в водных растворах — гидратированных) ионов (окислительный или анодный процесс) 2)переход этих ионов из р-ра с выделением их на поверхности Ме в виде нейтральных атомов, входящих в состав кристалл. решетки Ме (восст-ый или катодный процесс). При равновесном потенциале одновременно должны осуществляться два условия: на фазовой границе отсутствуют электрохим. и хим. превращения; потенциал сам переходит к одной и той же величине как от более высоких, так и от низких его значений.
Возникновение разности потенциалов между Ме и р-ром означает, что на границе раздела их фаз должны появиться на некотором расстоянии друг от друга полож.и отриц. заряж-е слои, которые и образуют двойной электр. слой — ДЭС.
Электрохим-ий ряд напряжений – последовательность расположения электродов в порядке возрастания их стандартных электродных потенциалов.
1 закон Фарадея: кол-во вещ-ва Ме окисл-ся на аноди или восст-ся на катоде прямопропорционально силе тока времени его прохождения. 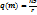 .
.
2 закон Фарадея: электрохим. эквиваленты различных вещ-в относятся, как их хим эквиваленты.
Хим-им эквивалент иона – отношение молярной массы A иона к его валентности z. Поэтому электрохим-ий эквивалент  . Второй закон Фарадея записывается в следующем виде:
. Второй закон Фарадея записывается в следующем виде: 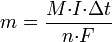
Коррозия – самопроизвольный протекающий пр-с разрушения поверхности Ме под действием агрессивной окружающей среды.
Хим-ая (газовая) коррозия – протекает при повышенных t0, когда конденсация влаги на метал-ой поверхности невозможна, т.е. происходит безтоковое окис-е Ме. Подвержены сопла ракетных двигаьелей, лопатки газовых турбин, аппараты синтеза аммиака. Продукты: оксиды, сульфиды, хлориды и т.д. соответствующих Ме.
Электрохим коррозия – протекает при наличии влаги, сопровождается возникновением тока в сист-ме, с разделением общего пр-са на 2 сопряженных, невозможных друг без друга – анодный и катодный (-)А: Ме0 – ne -> Men+, (+)K:2H+ + 2e ->  , при рН<7 или (+)К:О2 + 4е + 4Н+ -. 2H2O, при рН>=7
, при рН<7 или (+)К:О2 + 4е + 4Н+ -. 2H2O, при рН>=7
Защита от коррозии: 1) Антикоррозионное легирование Ме. От газовой коррозии. В сплав вводят компоненты, повышающие жаростойкость Ме (сопротивление к окисл-ию в области высоких t0). Используют хром, Ni, титан и др. 2) Нанесение защитных покрытий. Органич.покрытия: лаки, краски, эмали, битумы и т.д. Неорганич: метал-ие и неметалл-ие пленки. По хар-ру действия делятся на анодные (покрываемый Ме имеет более отриц. значение потенциала, чем основной) и катодные (наоборот).
К катодным покрытиям относятся такие металлические покрытия, потенциалы которых имеют более положительное значение, чем потенциал основного металла. Примеры: медь, серебро, никель. При повреждении покрытия или при наличии в нем пор возникает коррозионный элемент, в котором основной материал служит анодом и растворяется (коррозирует), а материал – катодом, на котором выделяется водород или поглощается кислород. Таким образом, катодные покрытия могут защищать основной металл от коррозии лишь при отсутствии на нем повреждений или пор.
Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинковое покрытие на стальных изделиях. При повреждении покрытия анодом будет служить металл покрытия, а основной металл, в качестве катода, разрушению подвергаться не будет. Потенциалы металлов зависят от состава растворов, поэтому, например, покрытие стали оловом (лужение) в растворе серной кислоты является катодным, а в растворе органических кислот – анодным.
Протекторная защита Торможение анодных или катодных реакций коррозионных процессов. К защищаемой конструкции присоединяют металл с более отрицательным электродным потенциалом, чем потенциал металла конструкции. Этот металл называется протектором, а защита от коррозии – протекторной защитой. При хорошем контакте защищаемый металл (например, железо) и металл протектора (например, цинк) оказывают друг на друга поляризующее действие в соответствии с их положением в ряду активности металлов. Железо поляризуется катодно, а цинк – анодно. В результате на железе идет процесс окисления того окислителя, который вызывает коррозию (это обычно растворенный в воде кислород), а цинк окисляется.. В водных средах и почвах.
Катодная защита.С помощью электр.тока, наложенного из вне на электроды. Защищаемое изделие присоединяют к отриц.полюсу внешнего источника постоянного тока, анод обычно изготовлен из инертного материала (графит или свинец). На электродах происходит газовыделение, в основе метода лежит явл-е поляризации. Окисл-е в сис-ме не происходит.
Вода (оксид водорода) — хим-ое вещ-во в виде прозрачной жидкости, не имеющей цвета (в малом объёме), запаха и вкуса (при нормальных условиях). Хим формула: Н2O. В твёрдом состоянии – лед или снег, а в газообразном — водяным паром. Около 71 % поверхности Земли покрыто водой (океаны, озёра, реки, лёд).
Хим. св-ва: 1) Вода реагирует со многими Ме с выделением водорода. 2) вода разлагается на водород и кислород при действии электр. тока. 3)реагирует со многими оксидамиНеМе 4) Некоторые оксиды металлов также могут вступать в реакции соединения с водой. 5) Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так гидраты. 6) Особая реакция воды – синтез растениями крахмала (C6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода.
Физико-хим свойства: 1. Полярность. Высокая полярность молекул воды объясняется несовпадением центров тяжести ее положительных и отрицательных зарядов. 2. Наличие водородных связей. Молекулы воды связаны между собой водородными связями. По прочности они занимают промежуточное положение между ков-ми и межмолек-ми связями. Причиной образования водородной связи – смещение единственного е- водорода к сильно электроотрицательному атому кислорода. При этом водород превращается в частицу с уникальными свойствами: а) не имеет е-, поэтому не отталкивается, а притягивается электр. оболочками других частиц; б) обладает ничтожно малым размером и, следовательно, большим поляризующим действием. 3. Способность к донорно-акцепторному взаимодействию. Вода проявляет св-ва донора за счет неподеленной пары е- атома кислорода. Этим объясняется высокая хим активность воды и способность ее к комплексообразованию в качестве лигандов. Вода относится к слабым электролитам и поэтому ионизирует в небольшой степени
Строение воды. Н2О (оксид водорода) – устойчивое соединение, с массовой долей водорода 11,10 % и кислорода – 88,91 %. Известно до 36 разновидностей молекул воды, состоящих из сочетаний изотопов водорода (протия – 11Н; дейтерия – 21D и трития – 31Т) и кислорода с массовыми числами от 14 до 19. На долю стабильного изотопа Н2О (где кислород с массовым числом 16) приходится 99,73 % от массы воды. Между атомами водорода (1s1) и кислорода (1s22s22р4) в молекуле воды образуются две ковалентные полярные связи по обменному механизму. По методу валентных связей атом кислорода в молекуле воды находится в состоянии sр3-гибридизации. Две гибридные орбитали атома кислорода перекрываются с s-орбиталями двух атомов водорода, а на двух других гибридных орбиталях кислорода располагаются две несвязывающие электр. пары. В результате отталкивания связывающих и несвязывающих электронных пар валентный угол в молекуле жидкой воды равен 105о
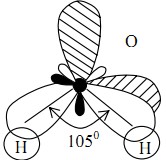 Неподеленные пары электронов кислорода влияют на строение молекулы воды, придавая ей тетраэдрическую структуру. Орбитали, с неподеленными электр. парами, направлены к противоположным от протонов вершинам тетраэдра. Поэтому около протонов создается пониженная электронная плотность (+), а вокруг орбиталей с неподеленной парой электронов – повышенная электронная плотность (-).
Неподеленные пары электронов кислорода влияют на строение молекулы воды, придавая ей тетраэдрическую структуру. Орбитали, с неподеленными электр. парами, направлены к противоположным от протонов вершинам тетраэдра. Поэтому около протонов создается пониженная электронная плотность (+), а вокруг орбиталей с неподеленной парой электронов – повышенная электронная плотность (-).
Жесткость воды обуславливается наличием в ней большого кол-ва солей Са2+ и Mg2+. Их ионы появляются в рез-те разрушения соответствующих минералов: известняков, доломитов, гипса.
Виды жесткости: 1) карбонатная(временная) обусловлена наличием гидрокарбонатов (НСО3) кальция, магния – Са(НСО3)2 Mg(НСО3)2; 2) некарбонатная (постоянная) наличие кальциевых или магниевых солей сильных кислот, главным образом хлоридов и сульфатов – CaCl2, MgCl2, CaSO4, MgSO4; 3 )общая опр-ся суммарным содержанием солей кальция и магния Жобщ=Жк+Жн.к.
Умягчение воды: м.осаждения предполагает переведение катионов Са2+ и Mg2+ в труднорастворимые соед-я, выпадающие в осадок с последущим удалением (фильтрацией или центрифугированием). термический м. для карбанатной ж. Воду нагревают почти до 1000С. При этом гидрокарбонаты разлагаются и переходят в труднорастворимые соед-я, выделяющиеся из р-ра в виде накипи; хим-ие методы: известкования – обработка воды гидроокисью кальция Са(ОН)2; садово-известковый – карб.ж.устраняется известью Са(ОН)2, а некорб.содой Na2CO3; щелочной – удаление ж.с помощью щелочи NaOH – дорого; фосфатный – Na3PO4; метод ионного обмена
Вяжущие — вещ-ва, способные затвердевать в результате физ-хим пр-в. Переходя из тестообразного в камневидное состояние, вяжущее вещество скрепляет между собой камни либо зёрна песка, гравия, щебня. спользуется для изгот-ия: бетонов, силикатного кирпича, асбоцементных и других необожжённых искусственных материалов; строительных растворов — кладочных, штукатурных и специальных. Бывают: органич(битумы, дёгти, животный клей, полимеры), которые переводят в рабочее состояние нагреванием, расплавлением или растворением в органических жидкостях. Неорганич – тонкомолотые материалы, способные при смешивании с водой образовывать вязко-пластичную массу, которая постепенно затвердевает, превращаясь в прочное камневидное тело. Для них характерны следующие признаки: гидрофильность, способность образовывать с водой тестообразную легко формующуюся массу (тесто), способность переходить из тестообразного состояния в твердое.
Воздушные при взаимодействии с водой, твердеют и длительно сохраняют прочность лишь в воздушной среде. При систематическом увлажнении бетоны, изделия и конструкции на воздушных вяжущих сравнительно быстро теряют прочность и разрушаются. К воздушным вяжущим веществам относят гипсовые и магнезиальные вяжущие, а также воздушную известь.
Гипсовыми материалы, для получения которых используют сырье, содержащее сернокислый кальций. Чаще это природные гипс и ангидрит реже - некоторые побочные продукты химической промышленности (фосфо-гипс, борогипс).
Гипсовые вяжущие применяют для производства гипсовой сухой штукатурки, перегородочных плит и панелей, архитектурных, звукопоглощающих и других изделий, а также строительных растворов для внутренних частей зданий.
Цементный камень – основа бетона и при воздействии агрессивной среды корродирует.
1 вид - в результате растворения и вымывания некоторых его составных частей. Наиболее растворимой является гидроксид кальция, образующийся при гидролизе трехкальциевого силиката. Растворимость Са(ОН)2невелика, но из цем.к. в бетоне под воздействием проточных мягких вод кол-во растворенного и вымытого Са(ОН)2 непрерывно растет, цементный камень становится пористым и теряет прочность(защитная корка из углекислого кальция, образующаяся на поверхности бетона в результате реакции между гидроксидом кальция и углекислотой воздуха – Са (ОН)2 + СО2 = СаСОз + Н2О)