Химические способы получения гидроксида натрия.
К химическим способам получения гидроксида натрия относятся известковый и ферритный.
Известковый способ получения гидроксида натрия заключается во взаимодействии раствора соды с известковым молоком при температуре около 80°С. Этот процесс называется каустификацией; он описывается реакцией
Na2C03 + Са (ОН)2 = 2NaOH + CaC03 (1)
раствор осадок
По реакции (1) получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92% NaOH. Расплавленный NaOH разливают в железные барабаны, где он застывает.
Ферритный способ описывается двумя реакциями:
Na2C03 + Fe203 = Na20 • Fe203 + C02 (2)
феррит натрия
Na20 • Fe203 -f H20 = 2 NaOH + Fe2O3 (3)
раствор осадок
реакция (2) показывает процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200°С. При этом образуется спек - феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции (3); получается раствор гидроксида натрия и осадок Fe2O3, который после отделения его от раствора возвращается в процесс. Раствор содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92% NaOH.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество топлива, получаемый едкий натр загрязнен примесями, обслуживание аппаратов трудоемко и др. В настоящее время эти методы почти полностью вытеснены электрохимическим способом производства.
Понятие об электролизе и электрохимических процессах.
Электрохимическими процессами называют химические процессы, протекающие в водных растворах или расплавах под действием постоянного электрического тока.
Растворы и расплавы солей, растворы кислот и щелочей, называемые электролитами, относятся к проводникам второго рода, в которых перенос электрического тока осуществляется ионами. (В проводниках первого рода, например металлах, ток переносится электронами.) При прохождении электрического тока через электролит на электродах происходит разряд ионов и выделяются соответствующие вещества. Этот процесс называется электролизом. Аппарат, в котором осуществляется электролиз, называется электролизером или электролитической ванной.
Электролиз используется для получения ряда химических продуктов— хлора, водорода, кислорода, щелочей и др. Следует отметить, что путем электролиза получают химические продукты высокой степени чистоты, в ряде случаев недостижимой при химических методах их производства.
К недостаткам электрохимических процессов следует отнести высокий расход энергии при электролизе, что увеличивает стоимость получаемых продуктов. В связи с этим проведение электрохимических процессов целесообразно только на базе дешевой электрической энергии.
Сырье для получения гидроксида натрия.
Для производства гидроксида натрия, хлора, водорода используют раствор поваренной соли, который подвергают электролизу Поваренная соль встречается в природе в виде подземных залежей каменной соли, в водах озер и морей и в виде естественных рассолов или растворов. Залежи каменной соли находятся в Донбассе, на Урале, в Сибири, Закавказье и других районах. Богаты солью у нас в стране и некоторые озера.
В летнее время происходит испарение воды с поверхности озер, и поваренная соль выпадает в виде кристаллов. Такая соль называется самосадочной. В морской воде содержится до 35 г/л хлорида натрия. В местах с жарким климатом, где происходит интенсивное испарение воды, образуются концентрированные растворы хлорида натрия, из которых он кристаллизуется. В недрах земли, в пластах соли протекают подземные воды, которые растворяют NaCl и образуют подземные рассолы, выходящие через буровые скважины на поверхность.
Растворы поваренной соли, независимо от пути их получения содержат примеси солей кальция и магния и до того, как они передаются в цеха электролиза, подвергаются очистке от этих солей. Очистка необходима потому, что в процессе электролиза могут образовываться плохо растворимые гидроокиси кальция и магния, которые нарушают нормальный ход электролиза.
Очистка рассолов производится раствором соды и известковым молоком. Помимо химической очистки, растворы освобождаются от механических примесей отстаиванием и фильтрацией.
Электролиз растворов поваренной соли производится в ваннах с твердым железным (стальным) катодом и с диафрагмами и в ваннах с жидким ртутным катодом. В любом случае промышленные электролизеры, применяемые для оборудования современных крупных хлорных цехов, должны иметь высокую производительность, простую конструкцию, быть компактными, работать надежно и устойчиво.
Электролиз растворов хлористого натрия в ваннах со стальным катодом и графитовым анодом.
Дает возможность получать гидроксид натрия, хлор и водород в одном аппарате (электролизере). При прохождении постоянного электрического тока через водный раствор хлорида натрия можно ожидать выделения хлора:
2CI- — 2е Þ С12 (а)
а также кислорода:
20Н- - 2е Þ 1/2О2 + Н2О (б)
или
H20-2eÞ1/2О2 + 2H+
Нормальный электродный потенциал разряда ОН--ионов составляет + 0,41 в, а нормальный электродный потенциал разряда ионов хлора равен + 1,36 в. В нейтральном насыщенном растворе хлористого натрия концентрация гидроксильных ионов около 1 ·10-7 г-экв/л. При 25° С равновесный потенциал разряда гидроксильных ионов будет
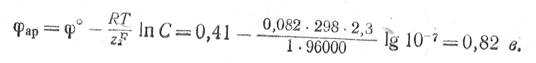
Равновесный потенциал разряда, ионов хлора при концентрации NaCI в растворе 4,6 г-экв/л равен
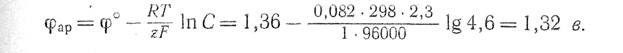
Следовательно, на аноде с малым перенапряжением должен в первую очередь разряжаться кислород.
Однако на графитовых анодах перенапряжение кислорода много выше перенапряжения хлора и поэтому на них будет происходить в основном разряд ионов С1- с выделением газообразного хлора по реакции (а).
Выделение хлора облегчается при увеличении концентрации NaCI в растворе вследствие уменьшения при этом величины равновесного потенциала. Это является одной из причин использования при электролизе концентрированных растворов хлорида натрия, содержащих 310—315 г/л.
На катоде в щелочном растворе происходит разряд молекул воды по уравнению
Н20 + е = Н + ОН- (в)
Атомы водорода после рекомбинации выделяются в виде молекулярного водорода
2Н Þ Н2 (г)
Разряд ионов натрия из водных растворов на твердом катоде невозможен вследствие более высокого потенциала их разряда по сравнению с водородом. Поэтому остающиеся в растворе гидроксид - ионы образуют с ионами натрия раствор щелочи.
Процесс разложения NaCI можно выразить таким образом следующими реакциями:
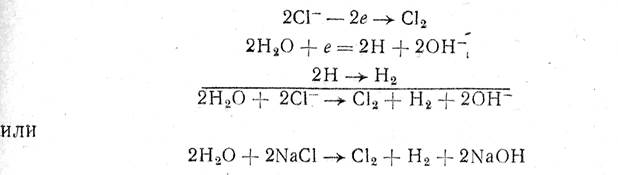
т. е. на аноде идет образование хлора, а у катода — водорода и гидроксида натрия.
При электролизе, наряду с основными, описанными процессами, могут протекать и побочные, один из которых описывается уравнением (б). Помимо этого, хлор, выделяющийся на аноде, частично растворяется в электролите и гидролизуется по реакции
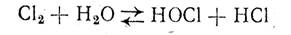
В случае диффузии щелочи (ионов ОН-) к аноду или смещения катодных и анодных продуктов хлорноватистая и соляная кислоты нейтрализуются щелочью с образованием гипохлорита и хлорида натрия:
НОС1 + NaOH = NaOCl + Н20
НС1 + NaOH = NaCl + Н20
Ионы ClO- на аноде легко окисляются в ClO3-. Следовательно, из-за побочных процессов при электролизе будут образовываться гипохлорит, хлорид и хлорат натрия, что приведет к снижению выхода по току и коэффициента использования энергии. В щелочной среде облегчается выделение кислорода на аноде, что также будет ухудшать показатели электролиза.
Чтобы уменьшить протекание побочных реакций, следует создать условия, препятствующие смешению катодных и анодных продуктов. К ним относятся разделение катодного и анодного пространств диафрагмой и фильтрация электролита через диафрагму в направлении, противоположном движению ОН -ионов к аноду. Такие диафрагмы называются фильтрующими диафрагмами и выполняются из асбеста.
Повышение температуры электролиза и концентрации NaCl в электролите, благодаря которым уменьшается растворимость хлора, а также снижение концентрации NaOH в католите сокращают вероятность побочных процессов.
Повышение температуры электролиза увеличивает не только выход по току, но и электропроводность электролита, благодаря чему снижается напряжение на ванне. Таким образом, повышение температуры уменьшает расход электрической энергии и поэтому обычно электролиз растворов хлорида натрия проводят при 70—80° С.
Промышленные электролизеры с фильтрующей диафрагмой широко применяются в промышленности. Схема такой ванны приведена на рис. 1 Ванна имеет стальной перфорированный (с отверстием) катод и графитовый анод. К катоду плотно прилегает фильтрующая диафрагма из асбестового картона.
 Раствор хлорида натрия подается в анодное пространство, фильтруется сквозь диафрагму и достигает катода. Скорость фильтрации электролита характеризуется так называемой протекаемостью диафрагмы v (см3/ч) и зависит от площади сечения диафрагмы F (см1), гидростатического давления столба электролита h, толщины диафрагмы b (см) и вязкости электролита μ.
Раствор хлорида натрия подается в анодное пространство, фильтруется сквозь диафрагму и достигает катода. Скорость фильтрации электролита характеризуется так называемой протекаемостью диафрагмы v (см3/ч) и зависит от площади сечения диафрагмы F (см1), гидростатического давления столба электролита h, толщины диафрагмы b (см) и вязкости электролита μ.
При прохождении постоянного электрического тока на аноде образуется хлор, на катоде — водород и щелочь, которая, проходя через отверстия катода, стекает в катодное пространство и удаляется из ванны.
Рис. 1.
Схема ванны с фильтрующей диафрагмой:
1— диафрагма; 2 — стальной катод;
3 — катодное пространство;
4 — анод; 5 — анодное пространство
В ваннах не происходит полного разложения поваренной соли и
устанавливается постоянная концентрация щелочи и неразложившейся поваренной соли.
В электролитическом щелоке, вытекающем из ванны, содержится 110—120 г/л NaOH и 180—170 г/л NaCl.
Промышленные электролизеры должны иметь большую производительность, что достигается увеличением нагрузки. Применение катодов с очень развитой поверхностью позволяет создавать компактные электролизеры с нагрузкой до 50000 а. Диафрагма в этом случае насасывается или «осаждается» на поверхность катода из суспензии асбестового волокна в соляно-щелочных растворах при помощи вакуума.

Рис. 2. Ванна с осажденной диафрагмой:
1— бетонное днище; 2 — стальной катод; 3 — бетонная крышка; 4 — труба для подачи рассола; 5 — труба для отвода хлора; 6 — графитовые аноды; 7 — штуцер для удаления водорода; 8 — трубка для слива электролитического щелока; 9 — медный токоведущий
стержень
Примером ванны с осажденной диафрагмой может служить ванна Хукера типа S, рис. 2. Эта ванна состоит из трех основных частей — бетонного днища, стального катода и бетонной крышки. Днище имеет форму прямоугольного корыта, в котором залиты свинцом нижние концы графитовых анодов и медный стержень, служащий для подвода тока. Аноды представляют собой графитовые пластины. Катод — стальная рама, внутри которой смонтирован ряд плоских карманов из стальной сетки. Расположение карманов и их ширина таковы, что установке катода на днище ванны карманы помещаются точно между анодами.
В крышке ванны расположены отверстия для подачи рассола и отвода хлора. Электролизер имеет тепловую изоляцию уменьшающую потери энергии за счет отдачи тепла в окружающую среду.
Электролиз растворов хлорида натрия в ваннах с ртутным катодом и графитовым анодом.
Дает возможность получать более концентрированные продукты, чем в ваннах с диафрагмой.
При пропускании через раствор NaCl постоянного электрического тока на графитовом аноде происходит разряд ионов С1- с последующим выделением газообразного хлора
2С1- - 2е Þ С12
На ртутном катоде выделение водорода происходит с большим перенапряжением. Если на железном катоде потенциал выделения водорода из нейтрального раствора равен 0,415 в, то на ртутном катоде он составляет 1,7 - 1,85 в. Натрий же на ртути выделяется с большим эффектом деполяризации, обусловленным образованием амальгамы натрия NaHgn, растворяющейся в избытке ртути. Благодаря этому потенциал разряда натрия на ртутном катоде оказывается ниже равновесного, а именно 1,2 в, в то время как его равновесный потенциал равен 2,71 в. Таким образом, на ртутном катоде протекают следующие процессы:
Na+ + е Þ Na
Na + nНg = NaHgn
и водород практически почти не выделяется.
Амальгама натрия разлагается в специальном аппарате — разлагателе водой по реакции
NaHgn + Н20 = NaOH + 1/2Н2 + nHg
Электролиз в ванне с ртутным катодом протекает в среднем при напряжении 4,3—4,4 в.
Ванна с ртутным катодом, принципиальная схема которой приведена на рис. 3, состоит из двух частей: электролизера и разлагателя.
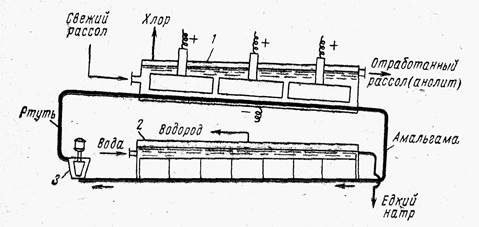 Электролизер и разлагатель конструктивно могут быть разделены и сообщаться друг с другом трубопроводом или могут быть расположены в одном общем кожухе.
Электролизер и разлагатель конструктивно могут быть разделены и сообщаться друг с другом трубопроводом или могут быть расположены в одном общем кожухе.
В любом случае электролизер — длинный ящик прямоугольного сечения, сверху закрытый крышкой, в которой укреплены графитовые аноды. Рис. 3. Схема ванны с ртутным катодом:
1— электролизер; 2 — разлагатель; 3 — насос
К слегка наклонному дну ванны подведена катодная шина и по нему непрерывно движется тонкий слой ртути. Таким образом, днище ванны является катодом. Электролизер питается концентрированным (310—315 г/л) раствором хлорида натрия, который в процессе электролиза обедняется поваренной солью до концентрации 260—270 г/л, выводится из ванны, обесхлоривается под разряжением и при продувке его сжатым воздухом, донасыщается солью, очищается от примесей (в схеме не показано) и передается обратно на электролиз. Образующийся хлор выводится через крышку ванны.
При движении ртути по дну электролизера в процессе электролиза получается амальгама натрия, которая растворяется в ртути и выводится из электролизера в разлагатель. Разлагатели могут быть различной конструкции — горизонтальные и вертикальные. Горизонтальные разлагатели представляют собой прямоугольный желоб, закрытый крышкой. В разлагатель поступает вода и из него отводятся образующиеся продукты — водород и щелочь. Дно разлагателя имеет небольшой уклон, благодаря чему ртуть движется по дну, выводится из разлагателя и подъемниками различного типа передается в электролизер.
Ванна с ртутным катодом занимает большие площади, что связано с горизонтальным расположением ртутного катода. Существуют ванны, в которых катодами служат вертикальные амальгамированные диски. Эти ванны компактны, но сложны конструктивно и в эксплуатации.
Сопоставление основных показателей работы ванн двух типов показывает, что вследствие высокого напряжения на ваннах с ртутным катодом расход энергии выше, чем в диафрагменных. Кроме того, эксплуатация ванн с ртутным катодом более сложна, чем диафрагменных, капитальные затраты на их установку выше и условия труда в цехах, оборудованных ртутными ваннами, тяжелее, чем в цехах, где установлены ванны с диафрагмой.
Возможность получения в ртутных ваннах концентрированных щелоков, свободных от поваренной соли, является существенным достоинством ртутных ванн. Исходя из этого во всех случаях, когда требуется чистая щелочь (например, для производства вискозного волокна), предпочтение должно быть отдано ваннам с ртутным катодом. В связи с ростом потребности в чистом каустике электролиз в ваннах с ртутным катодом приобрел большое распространение.
Щелочь, получаемая при электролизе, в виде растворов, подвергается концентрированию в выпарных аппаратах. Щелочь из диафрагменных ванн содержит до 130— 140 г/л NaOH и 180—170 г/л NaCl. Растворимость поваренной соли с увеличением концентрации NaOH в растворе падает. Так, в щелоке, содержащем 50% (769 г/л) NaOH, при 20° С растворимость NaCl составляет 13,9 г/л. Вследствие этого при выпарке электролитических щелоков, полученных в ваннах с диафрагмой, наряду с концентрированием раствора происходит кристаллизация хлорида натрия, который возвращается на электролиз. Практически после упарки и плавки получают щелочь, содержащую 92—94% NaOH, 2-3% NaCl.
Вывод.
Таким образом гидроксид натрия на сегодняшний день получают методом электролиза водного раствора хлорида натрия. При этом используются два вида электролизеров, каждый из которых имеет свои достоинства и недостатки. Но в обоих случаях процесс получения гидроксида натрия сопровождается получением газообразных побочных продуктов, которые являются опасными веществами как для человека так и для окружающей среды. Поэтому следует соблюдать особые меры безопасности на данном производстве.
Литература.
1. Общая химическая технология. Под ред. И.П. Мухленова. Учебник для химико-технологических специальностей вузов. М.: Высшая школа.
2. Фурмер И.Э., Зайцев В.Н. Общая химическая технология. – М.: Высшая школа, 1978.