Количество вещества — это величина, которая характеризует количество структурных однотипных единиц вещества.
Структурными единицами могут выступать различные частицы: молекулы, атомы, ионы, электроны.
Измеряется количество вещества в специальной единице — моль.
Расчет в структурных единицах очень неудобен, так как даже небольшое количество вещества содержит в себе очень много таких элементов, именно поэтому и была придумана специальная единица измерения, которая, как мы уже знаем, называется моль. 1 моль содержит в себе определенное число единиц вещества, называется оно числом Авогадро (постоянной Авогадро). Постоянная Авогадро: NA = 6,022 141 79(30)·1023 моль−1.
Единица измерения моль очень удобна и широко применяется в физике и химии, особенно когда важно детально выяснить количество вещества, вплоть до микроскопического состояния. Например, при описании химических реакций удобнее и точнее использовать количество вещества. Это электролиз, термодинамика, различные химические реакции, уравнения с идеальным газом и т. д. Точное вычисление количества вещества необходимо, например, для химических реакций с участием газов. Вот почему очень важен вопрос о том, как найти количество вещества газа. Ниже мы рассмотрим данный вопрос, когда приведем формулу расчета вещества газа.
Для вычисления количества вещества пользуются следующей формулой: n = m / M.
n - количество вещества
m - масса вещества
M - молярная масса вещества
Молярная масса представляет собой ту массу вещества, которая приходится на один моль вещества. Молярная масса равняется произведению молекулярной массы на число Авогадро.
Что касается газообразных веществ, то количество газа можно определить по объему: n = V / Vm
n - количество вещества
V - объем газа в нормальных условиях
Vm - молярный объем газа при нормальных условиях (равен 22,4 л/моль).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 л/моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 л /м.
Объединяя рассмотренные данные, получаем формулу, которая содержит в себе все расчеты:
n = m/M = V/Vm = N/NA
Число (N) атомов в порции углерода массой 0,012 кг легко определить, зная массу одного атома углерода (19,94·10-27 кг):
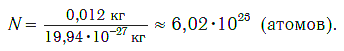
Следовательно, в углероде массой 0,012 кг содержатся 6,02·1023 атомов углерода и эта порция составляет 1 моль. Столько же структурных единиц содержится в 1 моль любого вещества.
Величина, равная:
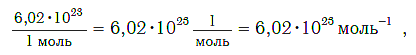
получила название постоянной Авогадро. Она является одной из важнейших универсальных постоянных и обозначается символом N A:
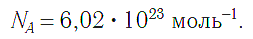
Единица в числителе дроби (1/моль) заменяет название структурной единицы.
Если структурной единицей вещества (например, меди, углерода) является атом, то в порции этого вещества количеством 1 моль содержатся 6,02·1023 атомов. В случае веществ молекулярного строения (вода, углекислый газ) их порции количеством 1 моль содержат по 6,02·1023 молекул. Если структурными единицами веществ немолекулярного строения (например, NaCl или CuSO4) являются их формульные единицы, то в порциях этих веществ количеством 1 моль содержатся по 6,02·1023 формульных единиц.
На заметку. Численное значение постоянной Авогадро огромно. О том, насколько велико это число, можно судить по следующему сравнению. Поверхность Земли, включая и водную, равна 510 000 000 км2. Если равномерно рассыпать по всей этой поверхности 6,02·1023песчинок диаметром 1 мм, то они образуют слой песка толщиной более 1 м.
Зная химическое количество n данного вещества Х, легко рассчитать число молекул (атомов, формульных единиц) N (Х) в этой порции:
если 1 моль вещества содержит 6,02·1023 молекул, то n моль вещества содержат N (Х) молекул.
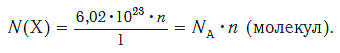
И наоборот, по числу структурных единиц можно рассчитать химическое количество вещества:
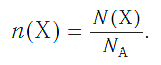

<img src="https://himi4ka.ru/uploads/posts/2016-03/1458389804_46.png" alt="" width="602" height="235" />

| Пример № 3. Сколько молей составляют и сколько молекул содержат 180 мл воды H2O? | |
| Д а н о V(H2O) = 180мл=180см3; ___________________ Найти: n(H2O); N(H2O) | Решение: Плотность воды ρ(H2O)=1г/см3 m(H2O)=V(H2O)·ρ(H2O)=180см3·1г/см3=180г Находим молярную массу воды М(H2O)=2+16=18 г/моль Находим количество вещества n(H2O)=m(H2O)/М(H2O)=180г/18г/моль=10 моль Число молекул равно N(H2O) =NA·n(H2O)=6,02·1023моль-1·10 моль=6,02·1024 Ответ: 180 мл воды составляют 10 моль и содержат 6,02·1024молекул |
| Пример № 4. Определите массу 0,25 моль серной кислоты | |
| Д а н о n(H2S04) = 0,25 моль ___________________ Найти: m(H2S04) | Решение: 1. Находим молярную массу серной кислоты М(H2S04)=2+32+64=98г/моль 2. Найдём массу вещества m=nM; m(H2S04)=n(H2S04)·M(H2S04)=0,25 моль98г/моль=24,5 г. Ответ:масса 0,25 моль серной кислоты равна 24,5 г. |
| Пример № 5. Какой объём при нормальных условиях занимают 2 моль любого газа? | |
| Д а н о n(газа)=2 моль ____________________ Найти: V | Решение: V= V M·n=22,4л/моль·2 моль=44,8л Ответ:2 моль любого газа при н. у. занимают объём 44,8 л |
| Пример № 6. Какой объём при нормальных условиях занимают 7г азота N 2? | |
| Д а н о m(N 2) = 7 г; ____________________ Найти: V(N 2) | Решение: М(N 2)=14·2=28 г/моль V(N 2) = V M·m/M=22,4 л/моль· 7г/28 г/г/моль= 5,6 л Ответ: 7 г азота при нормальных условиях занимают объём 5,6 л |
Краткие выводы: