Сераорганическими называются соединения, которые содержат атом серы, связанный с атомом углерода органической части молекулы.
Серосодержащие аналоги спиртов и фенолов называют тиолами, серосодержащие аналоги простых эфиров и органических пероксидов называют сульфидами и дисульфидами соответственно. Серосодержащие аналоги фенолов называют тиофенолами.
| Метантиол | CH3SH |
| Этантиол | CH3CH2SH |
| Тиофенол | C6H5SH |
| Диметилсульфид | CH3-S-CH3 |
| Диметилдисульфид | CH3-S-S-CH3 |
| Диметилсульфоксид | CH3-S(O)-CH3 |
| Диметилсульфон | CH3-S(O)2-CH3 |
Кислотные свойства. Тиолы более сильные кислоты, чем соответствующие спирты. Легкая поляризуемость атома серы способствует делокализации отрицательного заряда, образующегося алкилсульфид-иона RS- и, следовательно, повышает его стабильность. Тиолы образуют растворимые в воде соли – тиоляты – со щелочными металлами и нерастворимые – с тяжелыми металлами (ртутью, свинцом, цинком). Это свойство тиолов нашло отражение в устаревшем названии меркаптаны (от лат. mercurius captans – связывающий ртуть).
С2Н5SH + NaOH ⇄ C2H5SNa + H2O
Этантиолят натрия
2СН3СН2SH + HgCl2 → (C2H5S)2Hg ↓ + H2O
Этантиолят ртути (II)
Способность тиолов связывать ионы тяжелых металлов позволяет использовать их как противоядия при отравлениях соединениями мышьяка, ртути, хрома, висмута.
Основные свойства тиолов по отношению к протону практически отсутствуют.
Сульфиды являются слабыми основаниями.
Нуклеофильные свойства. Тиолы и сульфиды проявляют высокое сродство к атому углерода с пониженной электронной плотностью. К тому же они не образуют прочных водородных связей с протонными растворителями, и их неподеленные пары электронов доступны для взаимодействия с органическими реагентами. Все это обуславливает высокую нуклеофильность тиолов и сульфидов, реакции с которыми протекают в мягких условиях.
NaOH
|
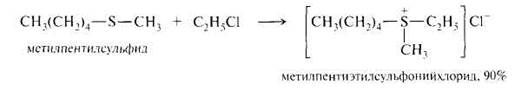
C2H5-SH + CH3J → C2H5-S-CH3
Сульфиды как сильные нуклеофилы взаимодействуют с алкилгалогенидами, диалкилсульфатами или аренсульфонатами с образованием сульфониевых солей, представляющих собой устойчивые кристаллические вещества, хорошо растворимые в воде.
Окисление и восстановление. Тиолы склонны к окислению и в зависимости от условий превращаются в различные серосодержащие соединения. При мягком окислении (кислород воздуха, пероксид водорода, иод, бром) тиолы превращаются в дисульфиды:
I2
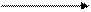 2 СН3-SH -2HI CH3-S-S-CH3
2 СН3-SH -2HI CH3-S-S-CH3
Связь S – S в дисульфидах непрочная, поэтому дисульфиды и легко восстанавлиываются в тиолы. [H]
 CH3-S-S-CH3 2 CH3SH
CH3-S-S-CH3 2 CH3SH
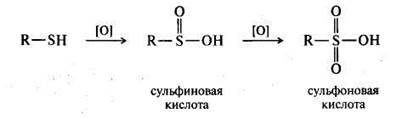
При жестком окислении тиолов (азотной кислотой, перманганатом калия) образуются сульфокислоты; промежуточными продуктами окисления являются малоустойчивые сульфиновые кислоты:
|
Сульфокислоты являются очень сильными кислотами. Особенно важное значение имеют сульфокислоты ароматического ряда и их производные.
|
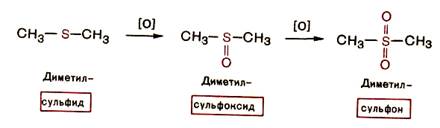
Сульфиды, как и тиолы, легко окисляются по атому серы. В зависимости от условий проведения реакции сульфиды могут быть окислены в сульфоксиды R-SO-R или сульфоны R-SO2-R.