К кетоновым телам относятся ацетоацетат, 3-гидроксибутират, и ацетон. Ацетон является конечным продуктом обмена и с энергетической точки зрения интереса для животного организма не представляет. При хорошем питании концентрация кетоновых тел в крови млекопитающихся не превышает 1мг100 мл. У жвачных эта цифра несколько выше из-за образования в стенке рубца 3-гидроксибутирата из масляной кислоты. Отношение 3-гидроксибутирата к ацетоацетату в крови колеблется между 1:1 и 10:1. Состояние, которое характеризуется повышенным содержанием кетоновых тел в крови и моче называют соответственно кетонемией и кетонурией. Будучи умеренно сильными кислотами ацетоацетат и 3-гидроксибутират, при условии их избыточного образования, могут вызвать истощение щелочных резервов крови и обусловить смещение реакции рН крови в кислую сторону – кетоацидоз или кетоз. Простейшая форма кетоза наблюдается при голодании. Он также отмечается при потреблении очень жирной пищи, при тяжелых физических нагрузках, избыточном приеме алкоголя, неконтролируемом сахарном диабете, токсикозе беременности у овец и кетозе лактирующих коров.
Синтез кетоновых тел происходит в митохондриях клеток печени. Основным предшественником ацетоацетата служит ацетил-КоА, образующийся в процессе b-окисления жирных кислот. Конденсация двух ацетил-КоА приводит к образованию ацетоацетил-КоА. Последний конденсируясь с ацетил-КоА под действием гидроксиметилглутарил-КоА-синтазы превращается в 3-гидрокси-3-метилглутарил-КоА. В дальнейшем 3-гидрокси-3-метилглутарил-КоА расщепляется ГМГ-КоА-лиазой на ацетоацетат и ацетил-КоА, который может вновь вовлекаться в данный путь. Ацетоацетат восстанавливается под действием НАДН2-зависимой дегидрогеназы в 3-гидроксибутират. Ацетон является продуктом спонтанного декарбоксилирования ацетоацетата. Некоторое количество ацетоацетил-КоА превращается в ацетоацетат под действием ацетоацетил-КоА-гидролазы по так называемому деацилазному пути синтеза кетоновых тел.
Кетоновые тела утилизируются во внепеченочных тканях – клетках мозга, почек, скелетных и сердечной мышц. Начальным звеном катаболизма 3-гидроксибутирата является его окисление НАД-зависимой дегидрогеназой до ацетоацетата. Ацетоацетат образует активную форму ацетоацетила-КоА в результате взаимодействия с сукцинил-КоА под влиянием КоА-трансферазы кетокислот.
Этот фермент является ключевым в утилизации кетоновых тел. Именно отсутствием этого фермента объясняется неспособность клеток печени использовать кетоновые тела для покрытия собственных энергетических потребностей. Образовавшийся ацетоацетил-КоА расщепляется на 2 ацетил-КоА, которые вовлекаются в цикл трикарбоновых кислот. Энергетическая ценность 3-гидроксибутирата и ацетоацетата составляет соответственно 26 и 23 АТФ.
Регуляция синтеза кетовых тел. Кетоз не возникает до тех пор, пока не происходит увеличения уровня свободных жирных кислот в крови, т.е. пока не происходит мобилизации жирных кислот из жировой ткани. Печень способна поглощать до 30% и более свободных жирных кислот. Поэтому все факторы, способствующие мобилизации жира, создают условия для кетогенеза.
Второй пункт регуляции связан с судьбой поступившей в гепатоцит жирной кислоты. Она может быть использована либо в реакциях синтеза триацилглицеринов или глицерофосфолипидов, либо подвергнута b-окислению. Окисление жирных кислот осуществляется в митохондриях и требует активного механизма транспорта через митохондриальные мембраны, который подавляется малонилом-КоА. Образование малонил-КоА происходит из ацетил-КоА, который поступает из митохондрий благодаря работе цитратного механизма. Этот механизм обеспечивает перенос цитрата образующегося в реакции конденсации оксалоацетата и ацетил-КоА. При голодании, сахарном диабете или других состояниях сопровождающихся кетогенезом в митохондриях отмечается дефицит оксалоацетата, обусловленный низкой скоростью метаболизма углеводов, которые являются основным его поставщиком и цитрата образуется очень мало. Поступление ацетила-КоА в цитозоль прекращается, образование малонил-КоА становится невозможным. В условиях отсутствия ингибитора транспорта жирных кислот в митохондрии они беспрепятственно окисляются в митохондриях до ацетил-КоА.
Образующийся при b-окислении жирных кислот ацетил-КоА должен вовлекаться в цикл Кребса. Однако такая возможность будет ограничена из-за дефицита оксалоацетата. Поэтому образующийся ацетил-КоА вовлекается на путь синтеза кетоновых тел. Введение углеводов имеет антикетогенное значение, т.к. приводит к увеличению концентрации оксалоацетата в митохондриях. Избыточная активация глюконеогенеза (использует оксалоацетат и функционирует в печени) также способствует развитию дефицита оксалоацетата в митохондриях и кетогенезу.
АЦИЛГЛИЦЕРИНЫ, СТРОЕНИЕ, СИНТЕЗ, РОЛЬ ГОРМОНОВ В МОБИЛИЗАЦИИ ИЗ ЖИРОВОЙ ТКАНИ.
Ацилглицерины – так называемые нейтральные жиры – являются сложными эфирами, образованными спиртом глицеролом и жирными кислотами. Гетерогенность ацилглицеринов определяется числом, природой и расположением жирнокислотных остатков. В зависимости от количества жирнокислотных остатков, входящих в структуру ацилглицеринов различают триацилглицерины, диацилглицерины и моноацилглицерины. В животном организме ацилглицерины представлены в основном триацилглицеринами. Почти все триацилглицерины являются смешанными, т.е. в их состав входят различные жирнокислотные остатки. Жирнокислотный состав триацилглицеринов в гораздо большей степени, чем состав других ацилсодержащих липидов зависит от характера питания, изменений температуры среды и других условий.
Триацилглицерины служат важнейшим источником энергии в организме. В форме триацилглицеринов депонируется запасы метаболического топлива. С энергетической точки зрения наибольшее значение имеют жирнокислотные компоненты. Энергетическая ценность триацилглицеринов составляет более 9 ккал/г, что заметно превышает таковую углеводов и белков.
У человека на долю триацилглицеринов приходится в среднем 10-20% массы тела. Этого количества вполне достаточно для обеспечения энергетических потребностей организма на протяжении 6 недель голодания. Запасные жиры могут использоваться в качестве источника энергии не только в условиях продолжительного голодания или зимней спячки, но также и для поддержания мышечной активности. В различных органах и тканях триацилглицерины локализуются в цитоплазме клеток в виде изолированных капелек. Наиболее велико содержание триацилглицеринов в жировой ткани, где на их долю приходится около 80% массы.
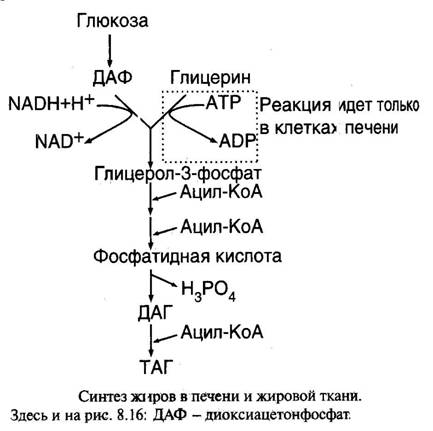
Синтез триацилглицеринов может осуществляться двумя различными путями - a- глицерофосфатным и моноглицеридным. Независимо от пути, в ходе синтеза триацилглицеринов используются активированные жирные кислоты. Активирование жирной кислоты осуществляется ацил-КоА-синтетатозой. Реакция сопровождается расходованием АТФ.
a-глицерофосфатный путь. Исходными субстратом этого пути является глицерол-3-фосфат.Глицерол-3-фосфат образуется двумя путями.
1.При фосфорилировании глицерина глицеролкиназой за счет фосфатной группы АТФ. Этот путь имеет место в печени. Глицерин поступает в печень из крови как продукт гидролиза триацилглицеринов хиломикронов и ЛПОНП липопротеинлипазой.
2.При восстановлении дигидроацетонфосфата (продукт гликолиза) НАД-зависимой глицерол-3-фосфатдегидрогеназой. Этот путь имеет место в жировой ткани, которая не имеет активной глицеролкиназы.
В ходе синтеза глицерол-3-фосфат дважды ацилируясь в реакциях с ацил-КоА через стадию 1-лизофосфатидата превращается в фосфатидат. Последний гидролизуется специфической фосфатазой до диацилглицерина, который затем взаимодействует с ацил-КоА с образованием триацилглицерина. Синтез триацилглицеринов по данному пути локализован в основном в печени и жировой ткани.
Многлицеридный путь. В тонком кишечнике в синтезе триацилглицеринов в качестве исходного субстрата используется моноацилглицерин, являющийся продуктом неполного гидролиза жиров в кишечнике. В ходе моноглицеридного пути моноацилглицерины двукратно ацилируясь в реакциях с ацил-КоА, через стадию диацилглицерина превращаются в триацилглицерин.
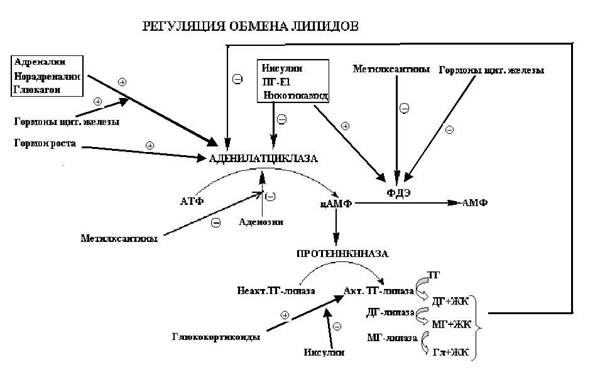
Мобилизация триацилглицеринов происходит в цитоплазме путем последовательного ступенчатого гидролитического отщепления жирных кислот. Этот процесс является необходимым этапом использования жиров в качестве энергетического материала.
Гидролиз триацилглицеринов инициирует триацилглицероллипаза. Этот фермент является гормончувствительным и активируется некоторыми гормонами. (См. схему). Под его влиянием триацилглицерин расщепляется на диацилглицерин и жирную кислоту. Дальнейший процесс гидролиза катализирует диацилглицероллипаза, активность которой зависит от количества субстрата, т.е. по сути от активности триацилглицероллипазы. Образующийся моноацилглицерин расщепляется моноацилглицероллипазой с образованием глицерола и жирной кислоты. Жирные кислоты в комплексе с альбуминами плазмы доставляются в ткани, где используются как энергетические субстраты. Глицерол используется печенью в реакциях глюконеогенеза.
ФОСФОЛИПИДЫ
Фосфолипиды – это гетерогенный класс липидов, содержащий в качестве структурного элемента остаток фосфорной кислоты. Большая часть фосфолипидов представлена глицерофосфолипидами.
ГЛИЦЕРОФОСФОЛИПИДЫ, СТРОЕНИЕ, БИОРОЛЬ, СИНТЕЗ, РАСПАД.
Глицерофосфолипиды являются производными глицерол-3-фосфата, гидроксильные группы которого замещены при С1 и С2 остатками длинноцепочных жирных кислот, а остаток фосфорной кислоты этерифицирован гидроксильной группой спиртового компонента. У большинства глицерофосфолипидов во втором положении, как правило, находятся остатки ненасыщенных жирных кислот, тогда как первое положение занимают остатки насыщенных жирных кислот.
Гетерогенность глицерофосфолипидов обусловлена прежде всего различиями спиртового компонента. В составе глицерофосфолипидов остаток фосфорной кислоты может быть этерифицирован холином, этаноламином, серином, инозитом, глицерином и его производными. В соответствии с характером спиртового компонента глицерофосфолипидам присваивается соответствующее название. Основными из них являются фосфатидилхолины, фосфатидилсерины, фосфатидилэтаноламины, фосфатидилинозитиды и дифосфатидилглицерины.
Фосфолипиды входят в состав всех клеток. Особенно богат фосфолипидами головной мозг – около 6% от сырой массы, в плазме содержится около 0,2%.
Все фосфолипиды относятся к числу амфипатических или полярных липидов. Длинные углеводородные хвосты, характеризующиеся низким сродством к воде (гидрофобностью) образуют объемную липофильную область. Гидрофильная полярная группа представлена остатком фосфорной кислоты, этерифицированной спиртом. Наличие у фосфолипидов двух частей – сильно полярной и неполярной - имеет отношение к их способности образовывать мембраны. Практически все фосфолипиды клетки сосредоточены в ее мембранах.
Функции. 1.Глицерофосфолипиды наряду с другими полярными липидами формируют бимолекулярный липидный слой, составляющий основу биомембран. В бимолекулярном липидном слое углеводородные цепи жирных кислот обращены внутрь (хвост к хвосту), образуя непрерывную углеводородную фазу, а полярные головы молекул обращены к водной фазе.
2. Глицерофосфолипиды принимают участие в формировании наружного слоя липопротеиновых частиц и таким образом выполняют функцию транспорта нейтральных липидов.
3.Ненасыщенные жирнокислотные остатки, в частности арахидоновая кислота, мембранных ГФЛ, используется как субстрат в синтезе простагландинов.
4.Ненасыщенные жирнокислотные остатки мембранных ГФЛ являются также субстратом перекисного окисления липидов.
Синтез ГФЛ осуществляется в различных органах и тканях, особенно интенсивно – в печени, головном мозге и тонком кишечнике. Все типы глицерофосфолипидов синтезируются на мембранах эндоплазматического ретикулума.
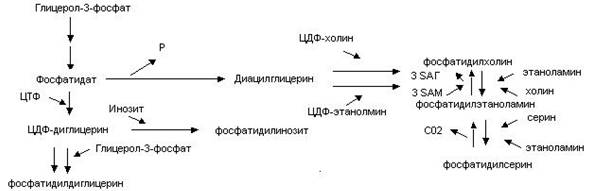
Ключевое положение в синтезе большей части глицерофосфолипидов занимают фосфатидные кислоты, т.е. до образования фосфатидных кислот синтез триацилглицеринов и глицерофосфолипидов совпадает. В дальнейшем пути синтеза различных типов ГФЛ расходятся.
Синтез дифосфатидилглицеринов и фосфатидилинозитидов связан с превращением фосфатидных кислот в липонуклеотиды – ЦДФ-диглицерины. Дифосфатидилглицерины синтезируются путем конденсации двух молекул ЦДФ-диглицерида с глицерол-3-фосфатом. Фосфатидилинозитиды образуются в результате присоединения к ЦДФ-диглицерину инозита.
Использованию фосфатидных кислот для синтеза фосфатидилхолинов, и фосфатидилэтаноламинов предшествует их дефосфорилирование до диацилглицеринов. Фосфатидилхолины и фосфатидилэтаноамины синтезируются путем присоединения к диацилглицерину активной формы соответственно ЦДФ-холина и ЦДФ-этаноламина. Образование фосфатидилхолина происходит также в результате трехкратного метилирования этаноламина в составе фосфатидилэтаноламина (донором метильных групп в данном случае служит S-аденозилметионин) или в реакции замещения этаноламина на холин.. Фосфатидилсерин образуется в результате замещения этаноламина серином. Фосфатидилсерин в ходе реакции декарбоксилирования превращается в фосфатидилэтаноламин.
Распад глицерофосфолипидов осуществляется в различных тканях двумя альтернативными путями. В ходе первого пути гидролитический распад глицерофосфолипидов начинается с отщепления жирных кислот под влиянием фосфолипаз А1 и А2. Образующиеся при этом 1 (или 2)-лизофосфоглицерины теряют оставшуюся жирную кислоту независимо от ее положения под действием лизофосфолипазы. Освободившийся глицерофосфорноспиртовый скелет расщепляется на глицерол-3-фосфат и соответствующее спиртовое основание.
Распад глицерофосфолипидов по второму пути начинается с гидролиза эфирной связи между диацилглицеринами и замещенной фосфорной кислотой под действием фосфолипазы С с образованием диацилглицерина и фосфорилированной формы спиртового основания Диацилглицерины подвергаются дальнейшему распаду на жирные кислоты и глицерин.
ХОЛЕСТЕРИН - СТРОЕНИЕ, БИОЛОГИЧЕСКАЯ РОЛЬ, СИНТЕЗ.
Строение. Холестерин является гидроксипроизводным циклопентан-пергидрофенантрена. Холестерин - наиболее распространенный стерин животного организма. Он содержится во всех тканях, как в свободном состоянии, так и виде эфиров жирных кислот
Функции. 1. Структурная функция. Практически весь свободный холестерин клетки сосредоточен в ее мембранах. Встраиваясь в липидный бислой, холестерин контролирует подвижность углеводородных хвостов мембранных липидов. Вследствие этого холестерин в известной мере обеспечивает определенное агрегатное состояние, необходимое для нормального функционирования мембраны.
Свободный холестерин служит также важнейшим структурным элементом внешней оболочки липопротеинов плазмы крови.
2. Метаболическая функция. Биологическая роль холестерина заключается также в том, что он является предшественником желчных кислот и стероидных гормонов, а один из интермедиатов синтеза холестерина - 7-дегидрохолестерин - служит предшественником холекальциферола (витамина Д3).
Эфиры холестерина, локализованные в форме липопротеидных мицелл в цитозоле, являются в основном запасной формой холестерина.
В составе липопротеинов плазмы свободный холестерин служит важнейшим структурным элементом, а эфиры холестерина являются в основном транспортной формой холестерина.
Холестерин крови. Холестерин является постоянным ингредиентом плазмы крови. Из млекопитающих человек обладает самым высоким уровнем холестерина: 3,64 - 6,76 ммоль/л. Большая часть холестерина плазмы крови (60-80%)находится в эстерифицированной форме. Жирнокислотный спектр эфиров холестерина плазмы крови в отличие от такового различных тканей характеризуется высоким содержанием полиненасыщенных жирных кислот.
Синтез холестерина осуществляется в различных органах и тканях, наиболее интенсивно в печени, тонком кишечнике и коже. Синтез холестерина представляет собой необратимый аэробный энергозависимый процесс, протекающий в цитоплазме.
В ходе синтеза холестерина различают следующие основные этапы.
1. Образование мевалоновой кислоты. Исходным продуктом синтеза является ацетил-КоА. В результате конденсации двух ацетил-КоА образуется ацетоацетил-КоА. Последний, взаимодействуя с еще одной молекулой ацетил-КоА превращается в 3-гидрокси-3-метилглутарил-КоА (ГМГ-КоА). Затем ГМГ-КоА восстанавливается до мевалоната под действием ГМГ-КоА-редуктазы.
2. Образование активной изопреновой единицы. Дважды фосфорилируясь с использованием АТФ и декарбоксилируясь, мевалонат превращается в изопентенилпирофосфат - активную изопреновую единицу.
3. Изомеризация изопреновых единиц и последующая конденсация 6 молекул в сквален.
4. Циклизация сквалена и образование холестерина.
Таким образом, в построении холестерина участвуют 6 активных изопреновых единиц, на образование которых используется 18 ацетил-КоА. Для синтеза холестерина потребляется 17 НАДФН2 и 18 АТФ на одну молекулу холестерина.
Для нормального функционирования синтеза холестерина необходимо наличие следующих витаминов:
Пантотеновая кислота - составная часть коэнзима- А;
РР (никотиновая кислота) - составная часть НАДФН2.
Регуляция синтеза холестерина. Ключевой регуляторной реакцией синтеза холестерина является превращение ГМГ-КоА в мевалонат, катализируемое ГМГ-КоА-редуктазой. Скорость этой реакции регулируется 2 путями.
1.По механизму фосфорилирования-дефосфорилирования. В фософрилирован-ной форме, которую поддерживает глюкагон ГМГ-КоА-редуктаза полностью не активна. Инсулин способствует проявлению активности фосфатазы, которая дефосфорилирует ГМГ-КоА-редуктазу и делает ее активной. Таким образом, глюкагон подавляет, а инсулин активирует синтез холестерина.
2.Изменением количества фермента, которое контролируется на уровне экспрессии гена ГМГ-КоА-редуктазы. Холестерин и некоторые его производные являются корепрессорами транскрипции гена ГМГ-КоА-редуктазы. Активаторами синтеза являются эстрогены.
Холестерин пищи подавляет синтез холестерина в печени, но не влияет на синтез в тонком кишнечнике.
Катаболизм холестерина. В процессе катаболизма холестерина не происходит деградации структуры циклопентанпергидрофенантрена..
Количественно наиболее важными продуктами трансформации холестерина являются желчные кислоты, синтез которых осуществляется в печени. Образующиеся в печени желчные соли вместе с определенным количеством холестерина (исключительно в свободном состоянии) выделяются в составе желчи в просвет кишечника. Снижение растворимости холестерина в мицеллах желчных солей желчи, обусловленное изменением соотношения желчных кислот и холестерина, особенно в сочетании с воспалительным процессом в желчном пузыре создает предпосылки для выпадения холестерина в осадок и образования желчных камней. Некоторая часть холестерина желчи подвергается в кишечнике реабсорбции и может быть вновь использована организмом. Энтерогепатическая циркуляция холестерина протекает менее эффективно и с меньшей скоростью, чем круговорот желчных кислот.