При взаимодействии металла с сухими газами (воздухом, газообразными продуктами горения топлива и др.) при высоких температурах происходит газовая химическая коррозия.
Этот вид коррозии может протекать в воздухе, в атмосфере водорода, водяных паров, метана и других углеводородов, оксидов углерода и серы, сероводорода, галогенов и их соединений. Наиболее часто на практике встречается газовая коррозия при окислении металлов О2, SO2, H2S, Cl2, НСl, NO3, CO2,CO и H2.
Она наблюдается при плавлении и термической обработке металлов, при эксплуатации газовых турбин, химических аппаратов, двигателей внутреннего сгорания и других металлических изделий, на внутренних стенках оборудования для хранения и транспортировки природных газов и в процессах их химической переработки. В связи с этим газовая коррозия наносит большой ущерб в различных отраслях, в первую очередь, металлургической, нефтегазовой и химической промышленности.
Этот вид коррозии возможен также при низких температурах, если при этом на поверхности металла не конденсируется жидкость, проводящая электрический ток.
Самым распространенным окислителем является кислород. Типичным продуктом кислородной газовой коррозии является окалина, которая в виде пленки возникает на раскаленных кусках металла при их прокатке.
Процесс газовой коррозии, в т. ч. с участием кислорода, включает следующие стадии:
- 1-я стадия: ионизация металла с образованием катионов и электронов, переходящих в оксидную пленку;
- 2-я стадия: диффузия катионов металла и электронов по направлению к газовой фазе;
- 3-я стадия: физическая адсорбция кислорода на чистой поверхности металла, приводящая к ослаблению связей между атомами в молекуле кислорода;
- 4-я стадия: химическая адсорбция, на которой при взаимодействии кислорода с металлом образуется оксидная пленка.
Возможность протекания химической коррозии определяется соответствующим изменением энергии Гиббса:

где R = 1,987 кал/(г·моль) – газовая постоянная; Т – термодинамическая (абсолютная) температура,К;  – равновесное давление кислорода в системе;
– равновесное давление кислорода в системе;  – начальное давление кислорода в газовой фазе.
– начальное давление кислорода в газовой фазе.
Таким образом, процесс окисления металлов:
- возможен, если  >
>  (
( < 0);
< 0);
- не возможен, если  <
<  ;
;
- коррозионная система находится в состоянии термодинамического равновесия, если  =
=  .
.
Для случая стандартных условий в коррозионной системе возможность протекания коррозионного процесса при любой температуре определяется из уравнения
 ,
,
где Kp – термодинамическая константа равновесия.
Для наиболее распространенного процесса газовой коррозии металлов характерна следующая реакция окисления металла кислородом

где m – число атомов металла в молекуле оксида; n – валентность металла.
Эта реакция проходит в две стадии. Вначале на поверхности металла адсорбируется слой кислорода по форме
Me + O2 → Ме/ 2О,
где запись Ме /2О обозначает твердую поверхность металла, покрытую слоем адсорбированного кислорода.
Во второй стадии происходит химическое взаимодействие (окислительный процесс), при котором окислитель (кислород), отнимая от металла валентные электроны, одновременно вступает с ним в химическое соединение, являющееся продуктом коррозии по соотношению
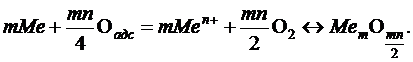
Стандартные значения Δ G º приведены в справочниках. Для подавляющего большинства металлов стандартная энергия Гиббса окисления ниже нуля, что говорит о возможности протекания реакции при атмосферном давлении кислорода (табл. 1).
Таблица 1
Изменение энергии Гиббса (Δ G) при окислении металлов
в атмосферных условиях (25 ºС; 0,1 МПа)
| Реакция окисления | Δ G, кДж/г-экв | Реакция окисления | Δ G, кДж/г-экв |
| K ↔ K+ | –360,9 | Ni ↔ Ni2+ | –102,6 |
| Na ↔ Na+ | –340,3 | Sn ↔ Sn2+ | –91,8 |
| Mg ↔ Mg2+ | –307,3 | Cu ↔ Cu2+ | –46,14 |
| Al ↔ Al3+ | –239,5 | Ag ↔ Ag+ | –8,51 |
| Zn ↔ Zn2+ | –153,6 | Pd ↔ Pd2+ | +16,54 |
| Cr ↔ Cr3+ | –150,3 | Ir ↔ Ir3+ | +17,84 |
| Fe ↔ Fe2+ | –127,3 | Pt ↔ Pt2+ | +30,0 |
| Co ↔ Co2+ | –105,5 | Au ↔ Au3+ | +65,73 |
Для большинства металлов условие Δ G > 0, при котором коррозия невозможна, проявляется при очень низких давлениях кислорода, не реализуемых на практике. Однако энергия Гиббса реакции меняется при изменении температуры (рис. 1).

| Рис. 1. Энергия Гиббса образования некоторых оксидов металлов при  =1:
1 – 2Ag2O4;
2 – 2ZnO;
3 – 2CO+O2→2CO2;
4 – 2MgO;
5 – 2/3 Al2O3;
6 – 2/3Cr2O3;
7 – 2C+O2→CO2;
8 – 2FeO;
9 – 2C+O2→2CO =1:
1 – 2Ag2O4;
2 – 2ZnO;
3 – 2CO+O2→2CO2;
4 – 2MgO;
5 – 2/3 Al2O3;
6 – 2/3Cr2O3;
7 – 2C+O2→CO2;
8 – 2FeO;
9 – 2C+O2→2CO
|
Как видно из рис. 1, большинство металлов в атмосфере кислорода могут подвергаться химической коррозии. Однако термодинамика указывает лишь на возможность протекания процессов, но не может предсказать их скорость.
Кинетика химической коррозии. Скорость химической коррозии зависит от многих факторов и в первую очередь от характера и продуктов коррозии. В процессе окисления на поверхности металла образуется твердая пленка оксидов. Для продолжения коррозии необходимо, чтобы ионы металла или кислород (или оба одновременно) диффундировали через эту пленку. Обычно с поверхности раздела «металл - оксид» в направлении от металла к внешней поверхности пленки происходит диффузия ионов металла, а не атомов, так как ионы металлов по размерам меньше атомов. Одновременно в этом же направлении должны перемещаться электроны. Ионы О2+ имеют больший радиус, чем атомы, поэтому с поверхности раздела оксид – газ в глубину пленки двигаются не ионы, а атомы кислорода, которые в пленке ионизируются (О + 2е = О2+) и, встречаясь с ионами металла, образуют оксиды.
Скорость окисления определяется сплошностью и защитными свойствами поверхностной пленки и зависит от наличия в ней трещин и пр. Поскольку пленки продуктов коррозии обычно хрупки и малопластичны, образование трещин в известной степени зависит от того, претерпевает ли пленка в процессе роста растяжения, благоприятствующие ее разрушению, или же она образуется в условиях сжатия. Это, в свою очередь, зависит от соотношения между объемами продуктов коррозии V ОК и металла V М, из которого они образовались:
 ,
,
где V ОК – объем оксида; M ОК – молярная масса оксида; ρ М – плотность металла; n – число атомов металла в молекуле оксида: M М – молярная масса металла; ρ ОК – плотность оксида.
Если V ОК/ V М <1, то образующаяся пленка не может быть сплошной и защищать металл от коррозии. Скорость роста пленки во времени у таких металлов остается постоянной (рис. 2, кривая 1).
Толщина пленки пропорциональна времени окисления:
 ,
,
где δ – толщина пленки; k – постоянная; τ – время окисления.

| Рис. 2. Рост толщины слоя пленки δ во времени по линейному (1), параболическому (2) и логарифмическому (3) законам |
Для щелочных и щелочноземельных металлов действительно наблюдается указанный линейный закон роста пленок во времени. При повышении температуры реакция окисления таких металлов начинает резко ускоряться вследствие плохого отвода теплоты. Рыхлая пленка оксида металла является препятствием для отвода теплоты, выделяющейся в ходе реакции. В результате происходит разогрев металла, скорость окисления его резко возрастает. Линейное увеличение толщины пленки во времени наблюдается также при высоких температурах для ванадия, вольфрама и молибдена, образующих летучие оксиды.
Для металлов, у которых в результате химической коррозии получаются сплошные пленки (V ОК/ V М >1), процесс коррозии будет тормозиться диффузией реагентов через пленку, и по мере утолщения пленки дальнейший рост ее будет все время замедляться. Для таких металлов (Fе, Со, Ni, Мn, Тi) в общем наиболее характерна параболическая зависимость для кинетики окисления (см. рис.2, кривая 2), которая простейшем случае (исключая начальный период роста пленки) определяется выражением:
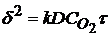 ,
,
где k – константа; D – коэффициент диффузии иона;  – концентрация кислорода в газе.
– концентрация кислорода в газе.
Для ряда металлов (Zn, Аl, Cr) установлена логарифмическая зависимость роста пленки во времени (рис. 2, кривая 3):
 .
.
Пленки у таких металлов обладают высокими защитными свойствами.
Различают тонкие, средние и толстые пленки. Толщина тонких пленок составляет от толщины монослоя молекул до 40 нм. Такие пленки на поверхности металла невидимы; их наличие может быть установлено с помощью специальных методов. Пленки средней толщины порядка 40–50 нм уже вполне соизмеримы с длиной волны видимых световых лучей. Эти пленки становятся видимыми вследствие их окраски. Толстые пленки могут достигать значительных толщин (например, окалина на стали, толстослойные анодные пленки алюминиевых сплавах).
При рассмотрении коррозии необходимо учитывать наличие на поверхности металла видимых и невидимых пленок, так как коррозийное поведение металла тесно связано с возникновением, устойчивостью и разрушением защитных пленок. Наиболее высокими защитными свойствами обладает сплошная, достаточно тонкая прочная эластичная пленка, имеющая хорошее сцепление с металлом и одинаковый с ним коэффициент линейного расширения, и возникающая на его гладкой поверхности. При этом пленка должна иметь некоторую оптимальную толщину, чтобы в достаточной степени тормозить встречную диффузию молекул агрессивного агента и ионов металла.
На большинстве металлов защитная пленка после достижения известной толщины растрескивается, что позволяет химической коррозии развиваться дальше. Разрушение пленки возможно по ряду причин. Если объем пленки больше объема металла, на месте которого она образовалась, то это приводит к появлению внутренних напряжений, сжимающих пленку параллельно поверхности и стремящихся оторвать ее от металла. Таким условиям соответствуют пленки соотношением V ОК/ V М >2,5. При высоких внутренних напряжениях пленка разрушается. Таким образом, важны не только защитные свойства пленки, но и ее механические свойства – прочность, упругость.
Скорость коррозии возрастает с увеличением температуры из-за повышения коэффициента диффузии и изменения защитных свойств пленки. Быстрое разрушение защитной пленки часто вызывает резкие температурные изменения.
Это связано, прежде всего, с различными коэффициентами линейного расширения металла и пленки.
До сих пор рассматривалось образование, устойчивость и разрушение защитных оксидных пленок, возникающих на металле при химическом взаимодействии его с кислородом. Но помимо кислорода ряд других газов может обладать сильными агрессивными свойствами по отношению к металлам при повышенных температурах. Наиболее активными газами являются фтор, диоксид серы, хлор, сероводород. Их агрессивность по отношению к различным металлам, а следовательно и скорость коррозии последних не одинаковы. Так, например, алюминий и его сплавы, хром и стали с высоким содержанием хрома устойчивы в атмосфере, содержащей в качестве основного агрессивного агента кислород, но становятся совершенно неустойчивыми, если в атмосфере присутствует хлор. Никель неустойчив в атмосфере диоксида серы, а медь вполне устойчива. Коррозия низколегированных и углеродистых сталей в выхлопных газах двигателей внутреннего сгорания, в топочных и печных газах сильно зависит от соотношения СО и О2. Повышение содержания О2 увеличивает скорость газовой коррозии и, наоборот, повышение содержания СО ослабляет коррозию. Ряд металлов (Со, Ni, Сu, Рb, Сd, Тi) устойчивы в атмосфере чистого водяного пара при температуре выше температуры кипения воды.
Таким образом, скорость химической коррозии определяется, прежде всего, свойствами возникающей при коррозии пленки на поверхности металла, характер которой определяется природой металла и окислителя, а также температурой.
Экспериментальная часть. Исследование кинетики окисления сплавов проводилось методом высокотемпературной гравиметрии.
Гравиметрия - это метод количественного анализа, основанный на точном измерении массы анализируемого вещества или его составных частей, выделенных в виде соединений точно известного, постоянного состава.
В зависимости от способа отделения определяемого компонента различают 3 гравиметрических метода:
· метод выделения;
· метод отгонки;
· метод осаждения.
Сущность метода выделения заключается в том, что определяемый компонент (аналит) выделяют из пробы в свободном состоянии (в виде элемента). Затем его точно взвешивают.
Сущность метода отгонки заключается в том, что определяемый компонент отгоняют в виде летучего соединения. Содержание аналита рассчитывают по изменению массы пробы в результате реакции. В прямом методе отгонки взвешивают отогнанное вещество: газ, полученный при проведении реакции, пропускают через поглотитель, который взвешивают до и после опыта.
В косвенном методе отгонки взвешивают остаток пробы после удаления летучего компонента. О количестве аналита судят по убыли массы пробы.
Сущность метода осаждения заключается в том, что определяемый компонент осаждают в виде малорастворимого соединения, которое фильтруют, прокаливают или высушивают, взвешивают и по массе продукта последней реакции рассчитывают массу аналита.
Скорость реакции «газ — металл» и развивающегося процесса образования окалины определяется характером слоя, образующегося на поверхности металла. Мерой образования окалины может служить, например, изменение массы Δ m или изменение толщины слоя δ. Однако, изменение массы проследить легче, чем изменение толщины слоя.
Массовый показатель коррозии (удельное изменение массы) Km показывает, насколько изменилась в результате коррозионного процесса масса исследуемого образца, отнесенная к площади поверхности металла:
K m = Δ m / S.
Массовый показатель коррозии может иметь положительное значение (если за время испытания масса образца увеличилась) или отрицательное (если масса уменьшилась после удаления продуктов коррозии).
Если наблюдается равномерное коррозионное разрушение, то массовый отрицательный показатель коррозии металла можно пересчитать в глубинный показатель K п:
K п = (K m×8,76)/ ρ Me,
где ρ Me – плотность металла.
Для эффективной работы материалов при высоких температурах необходимо знать кинетические параметры окисления, которые позволяют определить для каждого сплава наиболее оптимальные температурные режимы.
| а | 
|
| б | 
|
Рис. 3. Кинетика окисления сплавов системы Nb – Fe (а)
и влияние состава на скорость окисления (б)
Кинетику окисления сплавов и влияние легирующих элементов на жаростойкость сплавов можно оценить с помощью графиков, построенных в координатах «Удельное изменение массы – время» (рис. 3).
Скорость коррозии по массовому показателю коррозии определяется по формуле:
 .
.
Действие легирующих элементов на скорость коррозии, образование пленки и ее структуру имеет значение только для небольших количеств добавлений элементов, благодаря чему вид и состав слоя изменяются не основательно. В противоположность этому существует известные способы легирования для целенаправленного изменения свойств слоя и для повышения окалиностойкости.