Основные положения МКТ
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химического вещества.
В основе молекулярно-кинетической теории лежат три основных положения:
Все вещества –образованы из мельчайших частиц – молекул, которые сами состоят из атомов.
Атомы и молекулы находятся в непрерывном хаотическом движении.
Частицы взаимодействуют друг с другом силами, имеющими электрическую природу.
Макро и микропараметры
МКТ связывает свойства вещества с движением и взаимодействием молекул, то есть макромир и микромир.
Величины, характеризующее состояния макроскопических тел, называют макроскопическими параметрами.
m масса образца, V, P, T.
Величины, характеризующее свойства отдельных молекул, называют микроскопическими параметрами.
m0 (масса одной молекулы), V (средняя скорость молекул), Е (средняя кинетическая энергия молекул).
Молекулярная масса, количество вещества, число Авогадро, масса молекулы.
Масса молекулы выраженная в а.е.м. называют относительная молекулярная масса Mr.
m0c –масса атома углерода.

Величина, которая определяет количество молекул в данном образце называют – количество вещества. ν (ню).Единица измерения – моль.
1моль-кол-во вещества, в котором содержится столько же молекул или атомов, сколько содержится в 12 г углерода.
Количество молекул в одном моле называют постоянной Авогадро.
N а= 6,022 140 76⋅10²³ моль⁻¹
Масса 1 моля вещества называется молярной массой
Пр: М=18 г/моль=0,018кг/моль.





Чтобы определить молекулярную массу нужно воспользоваться таблицей Менделеева. Не забудьте перевести значение в систему СИ
Пр: М=12 г/моль=0,012кг/моль.
Температура
Температура характеризует состояние теплового равновесия тел.
Существует несколько шкал температур.
Шкала Цельсия — международной шкала температур за ноль принята температуру таяния льда при нормальном атмосферном давлении, 100 ° С — температуру пара кипящей воды при нормальном атмосферном давлении. 1/100 этого интервала — это 1 ° С (Цельсия). Обозначается t ° С.
Шкала Кельвина (термодинамическая шкала) — за ноль принята температура, при которой прекратилось бы тепловое движение частиц, из которых состоит тело.
Эту шкалу ввёл в 1848 г английский физик Уильям Томпсон (лорд Кельвин). Зная, что при росте температур тепловая скорость движения молекул и атомов тоже растёт, нетрудно установить, что при уменьшении температур скорость будет падать и при определённой температуре рано или поздно станет нулём, как и давление. Эту температуру и выбрали за начало отсчёта. Совершенно очевидно, что температура не может достигнуть значения меньше этого значения, поэтому оно получило название «абсолютный ноль температур». Для удобства же 1 градус по шкале Кельвина был приведён в соответствии с 1 градусом по шкале Цельсия.
Эта температура называется абсолютным нулем температур. Единица термодинамической шкалы температур в системе СИ — кельвин (К). Обозначается T (1 К = 1 ° С).
T = (273,15+t) K
По международной шкале абсолютный нуль соответствует температуре -273,15 ° С.
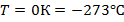
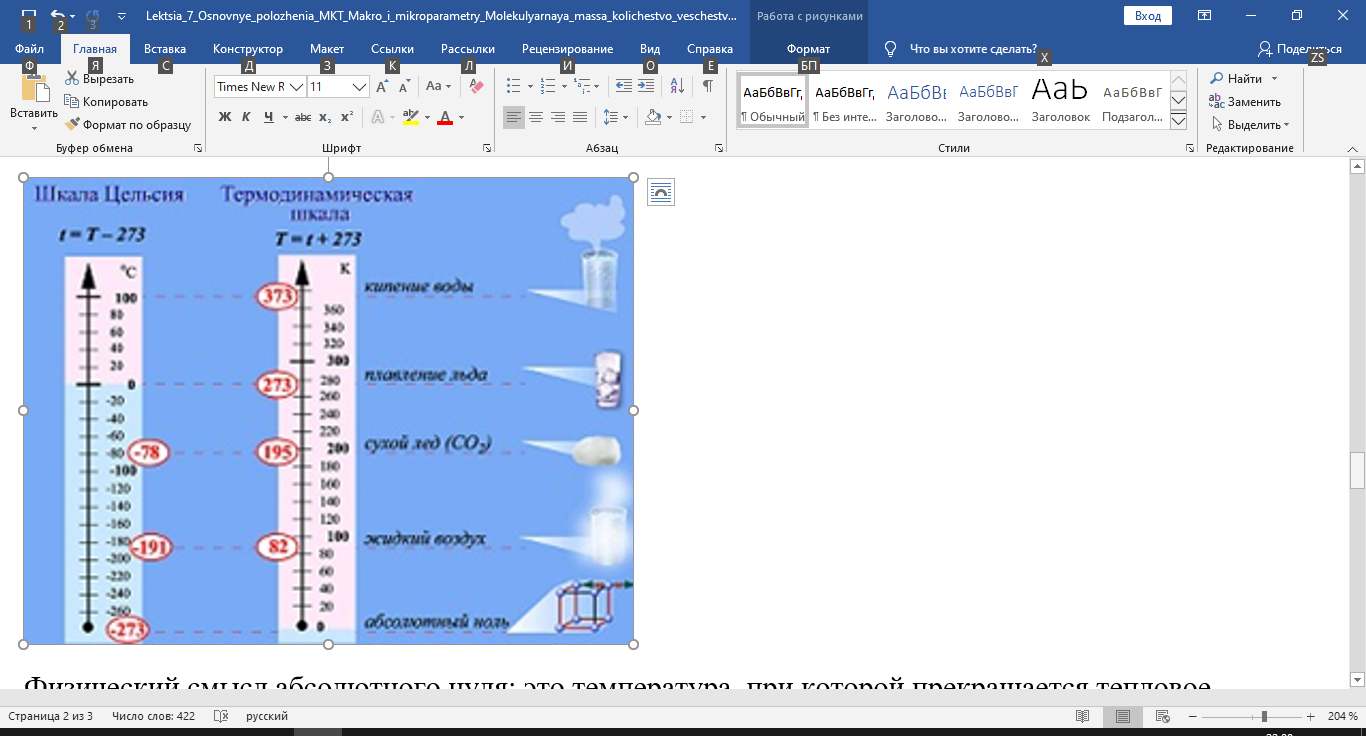
Физический смысл абсолютного нуля: это температура, при которой прекращается тепловое движение молекул.
Температуры - мера средней кинетической энергии молекул
Температуры является мерой средней кинетической энергии молекул
E=3/2kT Выберите макроскопические параметры газа
k=1.38 *  Дж/К (постоянная Больцмана)
Дж/К (постоянная Больцмана)
Теперь рассмотрим, как будет зависеть давление идеального газа от температуры. Для этого запишем основное уравнение МКТ в следующем виде:
Р=2/3 n Eк
Р-давление
n- концентрация молекул n=N/V
Р=nkT
P=1/3n m0 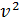
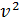 среднеквадратичная скорость
среднеквадратичная скорость
mo масса молекулы
Уравнение справедливо для идеального газа
Идеальный газ — это модель идеального газа, молекулы которого являются материальными точками, которые взаимодействуют только при столкновениях.