Цель занятия: изучить методы заражения куриных эмбрионов для культивирования вирусов.
Методы экспериментального заражения лабораторных животных.
Вируссодержащий материал может быть введен лабораторным животным различными методами. Наиболее часто используются заражения: подкожное (п/к), внутрикожное (в/к), внутримышечное (в/м), внутрибрюшинное (в/б), внутривенное (в/в), интраназальное (и/н), интраце-ребральное (и/ц). Однако в каждом конкретном случае исследователь стоит перед выбором введения материала каким-то одним способом.
Выбор метода заражения определяется тропизмом вируса. Под тропизмом вируса понимают способность его репродуцироваться в определенных типах клеток организма. Вирусы, репродуцирующиеся в нервных клетках, называются нейротропными(например, вирус бешенства), репродуцирующиеся в клетках кожи - дермотропными(например, вирус оспы), в клетках легких - пневмотропными(вирус гриппа). Вирусы, способные репродуцироваться в нескольких типахклеток, называются политропными(вирус инфекционного ринотрахеита крупного рогатого скота в клетках органов дыхания и размножения), а во всех типах клеток - пантропными(вирус чумы собак).
Зная тропизм вируса, материал вводят в органы, содержащие чувствительные к этому вирусу клетки. Например, вирус гриппа вводят интраназально, вирус оспы - внутрикожно, вирус бешенства - интрацеребрально. Пантропные вирусы лучше разносятся по организму при введении их внутривенно или внутрибрюшинно.
Если же исследователь не имеет данных о тропизме находящегося в материале вируса, то заражают животных нескольких групп разными методами.
Объем заражающей дозы материала значительно варьирует в зависимости от метода внесения и вида животных (0,1-5,0 мл).
Очень часто при первичном заражении не выявляется вирус, тогда через эти же биологические системы осуществляют второй и третий пассажи вирусов - «слепые пассажи». При отрицательном результате трех пассажей исследования по выделению активных форм вирусов прекращают. Под пассажемпонимают заражение чувствительной живой системы с целью получения от нее новой популяции вируса.
За зараженными животными ведут наблюдения, отмечая изменения в их поведении, появление специфических симптомов болезни в соответствии с инкубационным периодом данной инфекции.
Действие вируса проявляется на лабораторных и естественно-восприимчивых животных следующим образом: 1) гибелью через определенный период времени; 2) развитием клинических признаков болезни; 3) патоморфологическими изменениями в органах и тканях павших животных.
Известно, что фильтрующиеся вирусы в отличие от микробов не развиваются на искусственных питательных средах. Поэтому для культивирования их применяют другие методы: используются лабораторные модели культуры клеток, лабораторных животных и куриные эмбрионы.
В последнее время очень часто для культивирования вирусов применяют куриные эмбрионы (КЭ). Они имеет ряд преимуществ перед лабораторными животными:
1. Куриные эмбрионы дешевле лабораторных животных (яйцо в два - три раза дешевле белой мыши).
2. Не требуется затрат на содержание.
3. Легко фиксировать, проще работать.
Курные эмбрионы в большинстве случаев свободны от возбудителей спонтанных, скрытых вирусных заболеваний КЭ и в вирусологических лабораториях применяется с целью:
1. Выделения вируса из исследуемого материала.
2. Накопления вируса путем пассажа.
3. Проведения серодиагностики.
4. Получения живых и убитых эмбрион - вакцин.
5. Изучения свойств вирусов.
Куриные эмбрионы с успехом можно применять и для культивирования хламидий, риккетсий, бруцелл и других микроорганизмов.
Свежее племенное яйцо для КЭ желательно отбирать крупное с непигментированной скорлупой (лучше от кур породы Леггорн), от крупного эмбриона можно больше собрать вируссодержащего материала и в нем хорошо видны при овоскопии эмбрион и пуга. Кроме того эмбрионы породы Леггорн легко заражаются и неприхотливы к условиям инкубации.
Эмбрион должен быть не старше 7-9 суток, иначе будет большой отход при заражении.
Инкубацию производят при температуре +37°С - +38°С и относительной влажности 40-50% и яйца переворачивают 2-3 раза в день.
Зародыш формируется в яйце еще в утробе курицы. В 1-2 дня инкубации закладывается головной и спинной мозг, а также скелетная мускулатура. На 2-ой день закладывается сердце, кровеносные сосуды, нервы, а в дальнейшем половые железы. На 5-ый день бурно развивается головной мозг, появляются пигменты зрачка. На 8-е сутки эмбрион уже похож на цыпленка. На 9-10 сутки появляется пушок, а на 13-е сутки пух и ясные контуры цыпленка.
Под скорлупой находится перепончатая или подскорлуповая оболочка, которая у тупого конца раздваивается - один слой идет под скорлупой, окаймляя пугу (воздушную камеру), а другой над белком. Примерно в центре развивается эмбрион. Последний окружен аминионом, с противоположной стороны от аминиона находится желточная полость (мешок).
С 3-го дня начинает развиваться аллантоисная полость, где скапливаются продукты обмена КЭ, он огибает желток, распространяется к тупому концу, огибает зародыш и срастается с хорионом, располагающемся под скорлуповой оболочкой и образуется хорион аллантоисная оболочка. В остром конце яйца будет остаток белка, а в тупом пуга.
Через хорион аллантоисную оболочку осуществляется газообмен. Желток является главным резервуаром питательных веществ для зародыша. В аллантоис впервые дни выделяются продукты обмена веществ эмбриона, а по мере рассасывания белка аллантоис является поставщиком воды и минеральных веществ. Амнион служит буферной камерой для эмбриона. По мере роста и развития эмбриона объем желтка и белка уменьшается, а аллантоисная и амниотическая полость увеличивается.
Для заражения используют эмбрионы в возрасте 7-12 суток. Раньше 7 дней эмбрионы мелкие и плохо проводить заражение, а старше 12 дней КЭ не рекомендуется использовать, во первых, потому что жидкость полостей мутнеет и при хранении ее соли оседают в виде хлопьев, на которых также может адсорбироваться вирус. Во- вторых, на коже эмбриона появляется пушок, на котором также может адсорбироваться вирус.
Важным условием при работе с КЭ является соблюдение асептики. Необходимо предотвратить попадание в яйцо микробов. Если микробы попадут в яйцо, то они быстрее разовьются, чем вирус, и эмбрион может погибнуть еще до накопления вируса. Поэтому необходимо соблюдать следующие правила:
Существенно влияет на размножение вирусов в эмбрионах метод заражения. Перед заражением инкубированные яйца просвечивают, погибшие отделяют. На скорлупе яиц с живыми эмбрионами, которые различают по красному цвету кровеносных сосудов и движению эмбриона, карандашом отмечают место заражения.
Заражают эмбрионы в стерильном боксе, имеющем рабочий стол, два табурета, подводку газа, водопровод и вакуум. Заражение в амниотическую полость проводят в затемненной комнате. Рабочее место должно быть хорошо освещено. Перед работой стол дезинфицируют. Для дезинфекции поверхности яиц подготавливают антисептический раствор (70%-ный спирт, 2%-ный раствор йода) и обернутую ватой деревянную палочку, согнутый зубной зонд или бормашину для просверливания яичной скорлупы. Яйца заражают при помощи стерильных шприца для туберкулинизации и специальных игл. Место заражения на яйце заливают парафином. Для этого готовят парафиновые палочки: в пробирку, заполненную расплавленным парафином, вводят стеклянную палочку, следя за тем, чтобы она находилась в центре пробирки до остывания парафина.
Когда парафиновая палочка понадобится, стенки пробирки нагревают на горелке и за стеклянную палочку вытягивают парафин из пробирки. Подержав палочку над пламенем, расплавляют необходимое для закрытия отверстия в яйце количество парафина. Этот способ очень чист, и при нем не образуются пары парафина.
Кроме того, на рабочем столе в боксе размещают стакан со стерильными ватными тампонами, стакан с 3 % раствором едкого натра для использованных инструментов и сосуд с раствором хлорамина для использованных стеклянных предметов. В случае надобности можно приготовить подставку для яиц, небольшую эмалированную чашку и стерильные питательные среды. Подготовленный таким образом рабочий стол в течение 1–2 ч подвергают УФ-облучению.
Учитывая патогенность исследуемых вирусов, работы ведут в маске, резиновых перчатках и защитных очках.
Существует шесть методов заражения эмбрионов. Наиболее часто используют заражение в аллантоисную полость и на хорион аллантоисную оболочку, реже – в амниотическую полость и в желточный мешочек и совсем редко – в тело зародыша и в кровеносные сосуды ХАО. Выбор метода определяется тропизмом вируса, а также целью заражения. При любом методе заражения вводят 0,1–0,2 мл инфекционного материала.
Заражение в аллантоисную полость.
При заражении этим методом хорошо размножаются вирусы гриппа, ньюкаслской болезни, ринопневмонии лошадей, везикулярного стоматита и др. Существует несколько вариантов метода.
Первый вариант. Эмбрион фиксируют вертикально тупым концом вверх. В скорлупе на стороне зародыша, а иногда с противоположной зародышу стороны на 5–6 мм выше границы воздушной камеры делают отверстие диаметром около 1 мм. Иглу вводят параллельно продольной оси на глубину 10–12 мм (рис. 1). После инъекции вируссодержащего материала иглу извлекают, а отверстие в скорлупе закрывают каплей расплавленного стерильного парафина.
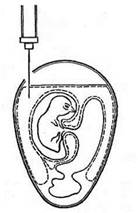
Рисунок 1. Заражение в аллантоисную полость
Второй вариант. Сделанное в скорлупе над воздушной камерой отверстие используют лишь для выхода части воздуха. Отверстие же для самого заражения делают на участке бессосудистой зоны хорион аллантоисной оболочки (ХАО) со стороны зародыша. Иглу вводят на глубину не более 2–3 мм. Инъецируют инфицирующую жидкость в объеме 0,1–0,2 мл и закрывают отверстие парафином.
Заражение на хорион аллантоисную оболочку.
Этот метод заражения куриных эмбрионов чаще используют для культивирования эпителиотропных и пантропных вирусов оспы, инфекционного ларинготрахеита птиц, чумы плотоядных, болезни Ауески, катаральной лихорадки овец и др.
Такое заражение может быть выполнено через естественную или искусственную воздушную камеру.
Для заражения через естественную воздушную камеру эмбрион помещают в штатив вертикально тупым концом вверх и в скорлупе против центра воздушной камеры вырезают круглое окно диаметром 15–20 мм. Через это окно пинцетом снимают подскорлупную оболочку. На обнажившийся участок ХАО наносят 0,2 мм вируссодержащей суспензии (рис. 2), отверстие закрывают лейкопластырем или реже покровным стеклом, укрепив его расплавленным парафином.
Заражение через искусственную воздушную камеру применяют чаще первого, так как оно обеспечивает контакт вируссодержащего материала с большей поверхностью ХАО и, следовательно, ведет к образованию большего количества вируса.

Рисунок 2. Заражение куриного эмбриона в аллантоисную полость (второй вариант) (по Николау)

Рисунок 3. Заражение на ХАО через естественную воздушную камеру (по Николау и др.)
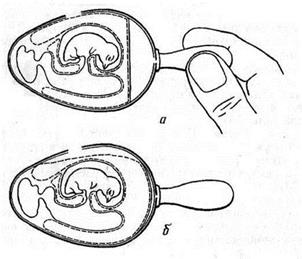
Рисунок 4. Заражение куриного эмбриона на ХАО через искусственную воздушную камеру (по Николау и др.)
Для заражения эмбриона этим методом его помещают в штатив горизонтально зародышем вверх. В скорлупе делают два отверстия: одно небольшое над центром воздушной камеры (предназначено для отсасывания из нее воздуха), а другое диаметром 0,2–0,5 см сбоку, со стороны зародыша. Сложность метода в том, что, делая второе отверстие, необходимо осторожно снять вначале кусочек скорлупы, затем скользящим движением, не повреждая ХАО, сдвинуть подскорлупную оболочку в сторону так, чтобы через образовавшийся дефект мог пройти воздух. После этого резиновой грушей через первое отверстие отсасывают воздух из естественной воздушной камеры (рис. 4, а). В результате через боковое отверстие наружный воздух устремляется внутрь, образуя искусственную воздушную камеру, дном которой является ХАО (рис. 4, б).
Через боковое отверстие на поверхность ХАО наносят инфекционную жидкость и отверстие закрывают кусочком лейкопластыря. Закрывать первое отверстие нет необходимости, так как внутренний листок подскорлупной оболочки при этом методе заражения не нарушается и продолжает выполнять роль барьера для микрофлоры окружающей среды.
Дальнейшую инкубацию эмбрионов, зараженных этим методом, проводят в горизонтальном положении боковым отверстием вверх.
Заражение в желточный мешок.
Большей частью им пользуются для размножения хламидий, а также вирусов болезни Марека, ринопневмонии лошадей, катаральной лихорадки овец и др. Заражают эмбрионы 5–7-дневного, а иногда и 2–3-дневного возраста (вирус лихорадки долины РИФ). Используют два варианта заражения.
Первый вариант. Эмбрионы помещают в штатив в вертикальном положении. Делают отверстие в скорлупе над центром воздушной камеры и вводят иглу на глубину 3,5–4 см под углом 45° к вертикальной оси в направлении, противоположном месту нахождения зародыша (рис. 5).
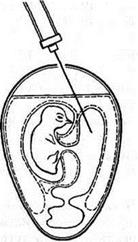
Рисунок 5. Заражение куриного эмбриона в желточный мешок (по Николау и др.)
Второй вариант. Иногда аналогичный путь заражения осуществляется на горизонтально укрепленном в штативе эмбрионе; при этом зародыш находится внизу, а желток над ним. Отверстие в скорлупе закрывают каплей расплавленного парафина.
Заражение в амниотическую полость.
Для этой цели используют эмбрионы 6 - 10-дневного возраста. Метод используется при культивировании вирусов гриппа, ньюкаслской болезни, ринопневмонии лошадей и др. Есть два способа заражения.
Закрытый способ. Заражение проводят в затемненном боксе. Яйцо помещают на овоскопе в горизонтальном положении зародышем вверх. Через отверстие в скорлупе над воздушной камерой вводят иглу с затупленным концом по направлению к зародышу. Доказательством того, что игла проникла в амнион, служит движение тела зародыша в направлении передвижения.
Открытый способ. Скорлупу над воздушной камерой срезают так, чтобы образовалось окно диаметром 1,5–2,5 см. Через него пинцетом под контролем глаза снимают подскорлупную оболочку. Затем анатомический (14 см) пинцет с сомкнутыми браншами ведут, продавливая хорион аллантоисную оболочку по направлению к зародышу. Когда пинцет достигнет его, бранши размыкают, захватывают амниотическую оболочку вместе с ХАО и подтягивают к окну. Удерживая левой рукой пинцет с фиксированной в нем оболочкой амниона, вводят вируссодержащий материал (рис. 6). Далее все оболочки опускают, окно закрывают лейкопластырем, и эмбрион инкубируют в вертикальном положении.
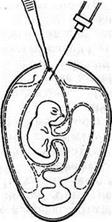
Рисунок 6. Заражение куриного эмбриона в амнион открытым способом (по Николау и др.)
Заражение в кровеносные сосуды ХАО.
При овоскопировании 11– 13-дневных эмбрионов отмечают крупный кровеносный сосуд. По его ходу удаляют участок скорлупы, наносят 1–2 капли спирта, что делает на некоторое время подскорлупную оболочку прозрачной. Под контролем глаза на овоскопе иглу вводят в сосуд, что подтверждается его подвижностью при небольших боковых движениях иглы. Обнаженный участок подскорлупной оболочки закрывают кусочком лейкопластыря.
Можно материал в сосуды ввести и несколько отличающимся способом: срезают скорлупу над воздушной камерой, подскорлупную оболочку смачивают спиртом и в ставшие видными сосуды ХАО вводят материал. Отверстие закрывают кусочком стерильного лейкопластыря.
Описанные технические приемы экспериментального заражения куриных эмбрионов не единственные, а имеют различные варианты.
Заражение в тело зародыша.
Для заражения используют эмбрионы 7–12-дневного возраста. Известно два варианта метода.
Первый вариант. Заражают так же, как в амнион закрытым способом, с той лишь разницей, что берут острую иглу и на овоскопе показателем попадания иглы в тело считают подчинение зародыша движениям иглы.
Второй вариант. Заражают так же, как в амнион открытым способом: через окно в скорлупе подтягивают пинцетом тело зародыша. Материал вводят в головной мозг или определенные участки тела. При таких методах заражения бывает значительный процент неспецифической гибели эмбрионов.
Накопление вируса в курином эмбрионе
Перед дальнейшей инкубацией на скорлупе зараженных любым методом куриных эмбрионов простым (графитным) карандашом пишут, чем заражен эмбрион и когда, а если нужно, то и другие сведения. Зараженные куриные эмбрионы помещают в термостат для дальнейшей инкубации, в процессе которой происходят репродукция внесенных вирусов и их накопление в соответствующих структурах. Температура инкубации эмбрионов варьирует от 33 до 38°С в зависимости от свойств вируса, которым проведено заражение. За эмбрионами ведут постоянное наблюдение, просматривают на овоскопе, отбирая павшие.
Гибель эмбрионов в первые 24 ч после заражения чаще всего обусловлена размножением грибов, бактериальной микрофлоры, внесенных в эмбрион вместе с инокулятом, или травмированием при заражении. Эта гибель считается неспецифической. В более поздние сроки эмбрионы гибнут в результате, как правило, размножения в эмбрионах вируса. Обнаружив погибшие эмбрионы, их сразу же переносят в холодильник с температурой 4 °С. Такие условия, с одной стороны, способствуют сохранению активности накопившегося в эмбрионе вируса, с другой – уплотнению тканей и запустению сосудов, что значительно облегчает последующее вскрытие.
Эмбрионы инкубируют до момента максимального накопления вируса. Для каждого вируса и даже штамма этот срок является определенным и варьирует в пределах от 2 до 7-8 сут. Так, для вируса ньюкаслской болезни штамма Н он составляет 2-3 дня, для того же вируса штамма В,– 5 дней, для вируса инфекционного ларинготрахеита птиц – 5 дней и т. д. Затем все эмбрионы умерщвляют охлаждением при 4 °С в течение не менее 3–4 ч и вскрывают.
Деэмбринированные яйца.
Воснове метода лежит удаление эмбриона из яйца в период, когда к его скорлупе изнутри полностью прилегает хорион аллантоисная оболочка. Если внутрь такого яйца добавить питательную среду, то образуется своеобразная культура ткани, в которой может размножаться вирус. Метод обладает рядом преимуществ: он позволяет получить более чистый вирус, чем в аллантоисно-амниотической жидкости, что важно для снижения аллергизирующих свойств вакцин, приготовленных из этого материала; отсутствие желточного мешка и, следовательно, содержащихся в нем специфических антител позволяет лучше размножаться некоторым вирусам. В некоторых случаях этот метод дает хорошие результаты в диагностических работах, так как при нем можно вводить большие количества исследуемого материала, что увеличивает возможность выделения вируса.
Метод предложил Бернкопф еще в 1949 г., но из-за трудностей применения широко не используется. Трудности эти связаны со свойством хорион аллантоисной оболочки в процессе инкубации отделяться от скорлупы, что снижает ценность культуры и затрудняет манипуляции получения вируса и замены питательной среды.
Е. Гройель (1963) ввел ряд модификаций, которые позволили устранить эти трудности. Он предложил использовать 15-дневные и даже более старые яйца, которые в процессе инкубации следует часто переворачивать для равномерного развития оболочки на скорлупе яйца. При просвечивании обозначают границы воздушной камеры. Скорлупу отпиливают на 0,5 см выше этой линии, на край скорлупной оболочки наливают расплавленный парафин (56-58С°), который застывая, фиксирует край яйца. Затем вырезают круглое отверстие в оболочке над зародышем, оставляя вокруг узкий ободок. Следующий этап – осторожное удаление зародыша из яйца. При этом яйцо следует удерживать в горизонтальном положении и медленно поворачивать. Таким путем находят сосуды, связывающие эмбрион с ХАО, и перерезают их ножницами. Если яйцо держать вертикально, то зародыш своей массой оттягивает оболочку, отрывая ее обычно в области острого конца яйца. Попадание даже небольшого количества жидкости между ХАО и скорлупой вызывает полную отслойку оболочки в течение 1–2 дней.
После удаления зародыша оболочку, выстилающую яйцо, несколько раз промывают физиологическим раствором, охлажденным до 4–0°С, до тех пор, пока жидкость не станет прозрачной. Затем в полость яйца вводят 20 мл питательной среды, подогретой до 37°С, и яйцо закрывают стерильным резиновым колпачком, предварительно погрузив его в парафин. Трубка с резиновой пробкой, вмонтированная в яйцо, обеспечивает как взятие, так и введение жидкости без опасности бактериального заражения. Такой биологический объект сохраняет жизнеспособность в течение нескольких дней.
По методике Йошино и других, полость деэмбринированных яиц заполняют раствором агара в растворе Хенкса. Заражают деэмбринированные яйца через трубку в колпачке.
Контрольные вопросы:
1. Что такое пуга?
2. Чем обрабатывают поверхность яйца?
3. Что такое пропизм?
4. В каком возрасте используют эмбрионы для заражения?
5. Через какое время наступает гибель КЭ если там идет размножение вируса?