Аэрозоли в окружающей среде
Классификация аэродисперсных систем.
Аэрозоли – дисперсные системы, в газовой дисперсионной среде которых находятся во взвешенном состоянии твердые или жидкие частицы дисперсной фазы.
Существуют три подхода к классификации аэрозолей.
1. По методу получения:
· диспергацонные аэрозоли, образуются при раздроблении твердых веществ, распылении жидкостей и порошков;
· конденсационные аэрозоли, образуются при конденсации из пересыщенных паров и в результате газовых реакций, при которых образуются не летучие продукты. Первые обычно грубодисперсные и имеют сильно различающиеся по величине частицы т.е более полидисперсные.
Различают аэрозоли следуюих видов:
Туман – конденсационный и диспергационные аэрозоли с жидкой дисперсной фазой;
Пыль – диспергационные аэрозоли с твердыми частицами;
Дым – конденсационные аэрозоли, получсемые при горении и содержащие твердые или жидкие частицы одновременно.
На практике часто всчтечаются аэрозоли, которые нельзя отнести ни к одному из этих типов – например, воздух вблизи промышленных центров содержит частицы сажи, пепла, продуктов сухой перегонки топлива, поглотивших из атмосферы влагу. Для этих особых аэрозолей, которые являются одновременно и дымом, и туманом, и пылью, используется специальное название «смог», происходящее от двух английских слов: smoke (дым) + fog (туман).
2. По агрегатному состоянию дисперсной фазы:
Приведем некоторые определения:
Золь – дисперсная система, в которой размер частиц отвечает коллоидной дисперсности, т.е. лежит в пределах от 10-5 до 10 -7 см.
Золи с газообразной дисперсной средой называют - аэрозолями, с жидкой - лиозолями. В зависимости от природы дисперсионной среды лиозоли делятся на гидрозоли, алкозоли, этерозоли и бензоли, у которых дисперсионной средой являются соотвественно вода, спирт, эфир, бензол.
Коллоидные системы (коллоидно-дисперсные системы, коллоиды) – предельно высокодисперсные(микрогетерогенные) системы. Частицы дисперсной фазы в коллоидной системе - коллоидные частицы- обычно имеют размер от 1 ни до 100 нм. В газе или жидкости они свободно и независимо одна за другой участвуют в интенсивном броуновском движении, равномерно заполняя весь объем дисперсионной среды.
Гели - высокодисперсные системы с жидкой дисперсионной средой, содержащей структурную сетку (каркас), образованную частицами дисперсной фазы. Типичные гели в виде студенистых осадков образуются из золей при их коагуляции или в процессах выделения новой фазы из пересыщенных растворов. Если дисперсионная среда газообразная, то образуются аэрогели.
Частица – единица порошка, которую нельзя легко разделить в обычных сепарационных процессах. Частица может состоять из нескольких зерен (рис. 1), поэтому термин «зерно» – не синоним слову «частица».
Порошки – двухфазные системы, представляющие собой твердые частицы дисперсной фазы, распределенные в воздухе или другой газовой среде. Или, другими словами, порошки представляют собой совокупность находящихся в соприкосновении индивидуальных твердых тел или их агломератов(агрегатов).
Классификация дисперсных систем по агрегатному состоянию представлена в табл1.[2]
Таблица 1
Классификация дисперсных систем по агрегатному состоянию фаз
| Дисперсная фаза | |||
| Дисперсная среда | Газовая | Жидкая | твердая |
| Газовая | - | Аэрозоли, туманы, капли | Аэрогели, аэрозоли, порошки, дымы, пыль |
| Жидкая | Пены, газовые эмульсии | Эмульсии, кремы | Золи, гели, эмульсии, пасты |
| Твердая | Твердые, дым, пыль, пены, фильтры, сорбенты, мембраны | Твердые эмульсии | Твердые золи, сплавы, композиты, покрытия, пленки |
Обычно к порошкам относят большинство сыпучих материалов. Однако термин порошки корректно применять к высокодисперсным системам с такими размерами частиц, при которых сила межчастичного взаимодействия становится соизмерима или меньше их веса. Согласно данному условию, размер каждой частицы лежит, как правило, в пределах от 1 нм до 1000 мкм. Дисперсные фазы величиной менее 1 нм обычно называют кластерами, 1000 мкм и более – гранулами. Порошки, состоящие из частиц с размером менее 1 мкм, взвешенные в газовой фазе и участвующие в броуновском движении, образуют аэрозоли, пыли и дымы.
Агломерат (агрегат) – несколько частиц, соединенных в более крупные образования. Агрегаты и агломераты различают по наличию внутренней пористости. В агломератах присутствуют межчастичные пустоты (рис.2,а), в агрегатах – нет (рис.2,б).[2]

Рис1. Соотношение агрегатов, частиц и областей когерентного рассеяния(ОКР): 1 – агрегат, 2 – частица, 3 - ОКР

Рис2. Схематическое изображение агломерированного(а) и агрегированного(б) порошка, 1-агломерат, 2–первичная частица, 3– внутриагломератная пора, 4 – межагломератная пора, 5 – агрегат, 6 – межагрегатная пора.
3. По размеру частиц дисперсной фазы:
Аэрозоли могут содержать частички различных размеров – от 10-9 до 10-3 м. при этом наиболее неустойчивы высокодисперсные и грубодисперсные аэрозоли. Первые – вследствие очень большой интенсивности броуновского движения частиц, в результате чего каждая частица за короткое время достигает стенок сосуда, в котором находится аэрозоль, или встречается с другой частицей, что приводит к коагуляции аэрозоля; грубодисперсные аэрозоли не устойчивы вследствие большей скорости седиментации, обусловленной низкими вязкостью и плотностью дисперсионной среды.
Размер частиц аэрозолей имеет огромное значение, поскольку ряд свойств частиц зависит от их размера. Так при атмосферном давлении сопротивление, оказываемое окружающей средой движению одной частицы, для частиц меньше 10-8 м пропорционально r2, в то время как для больших (10-7м) частиц - пропорционально r, интервал 10-8-10-7м является переходным. Так же зависимость наблюдается для скорости испарения теплообмена. Интенсивность рассеянного света пропорциональна r6 для частиц с r<10-7 м и r2- для частиц с r>10-5 м.
Аэрозоли обычно полидисперсные, размер частиц у них весьма различен от 10-9 до 10-8 м. В табачном дыме частицы имеют размеры 2*10-7-5*10-6м, в слоистых облаках капли от 4*10-6 до 10-5м и крупнее.
Наиболее характеры для аэрозолей то, что эти системы обладают только некоторой кинетической устойчивостью, агрегативной устойчивостью они не имеют, и каждое столкновение их частиц приводит к слипанию.
Промышленное значение аэрозолей двояко: переход в пылевидное и капельножидкое состояние значительно увеличивает реакционную способность вещества.
В системе - Жидкая / газообразная - 10-7 …10-5м (туман);
-Твердая / газообразная - 10-9 …10-5м (дым), d>10-5м (пыль).
Свойства аэрозолей.
1. Молекулярно – кинетические свойства. Важнейшими молекулярно – кинетическими свойствами аэрозолей являются:
· Способность частиц сохраняться во взвешенном состоянии;
· Способность частиц перемещаться преимущественно как единое целое.
Распределение концентрации частиц по высоте в покоящейся системе характеризуют параметром перреновская высота

где k – постоянная Больцмана; Т -температура системы; m1 –масса частицы, g- ускорение силы тяжести.
Если размер частицы меньше  , то частица дисперсной фазы способна находиться во взвешенном сотсоянии за счет энергии собственного теплого движения
, то частица дисперсной фазы способна находиться во взвешенном сотсоянии за счет энергии собственного теплого движения  .
.
Если размер частиц сопоставим с  то, для поддержания ее во взвешенном состоянии необходима дополнительная энергия. Эту энергию частица дисперсной фазы может получиться только в результате соударения с молекулами газовой фазы. Например, в псевдоожиженном (кипящем) слое частицы дисперсной фазы поддерживаются во взвешенном состоянии за счет восходящего потока газа.
то, для поддержания ее во взвешенном состоянии необходима дополнительная энергия. Эту энергию частица дисперсной фазы может получиться только в результате соударения с молекулами газовой фазы. Например, в псевдоожиженном (кипящем) слое частицы дисперсной фазы поддерживаются во взвешенном состоянии за счет восходящего потока газа.
Перемещение частиц аэрозоля относительно газовой фазы происходит под действием внешних полей – гравитационных, акустических, электрических, а так же сил инерции, градиентов, температур и концентраций. Под действием внешних полей частицы двигаются с постоянной скоростью из-за уравновешивания внешних сил и сил сопротивления среды движению частиц. Только в средах с сильной турбулентностью и в акустических полях частицы двигаются ускоренно. Все эти свойства используются при конструировании различных видов пылеулавливателей – гравитационных, инерционных, электрических, акустических и другие.
Движение части аэрозоля при наличие градиента концентрации называется диффузиоферезом, а при наличие температуры – термоферезом. Диффузиоферез происходит в близи поверхностей испарения или конденсации. Термоферез обусловлен тангенциальной силой, возникающей в результате действия на частицу движущегося потока газа. Частным случаем термофереза является фотофорез – движение частицы в результате светового облучения. Он возникает в результате неравномерного нагревания дисперсной фазы и дисперсионной среды из-за различной их способности отражать и поглощать свет.
Оптические свойства.
Для аэрозолей наиболее характерно поглощение и рассеяние света. Например, черный цвет дыма обусловлен поглощением угольными частицами всех излучений видимой области спектра.
Рассеяние света в аэрозолях описывает уравнение Рэля:

где  - интенсивность рассеянного излучения,
- интенсивность рассеянного излучения,  - интенсивность падающего излучения,
- интенсивность падающего излучения,  - длина волны излучения,
- длина волны излучения,  - частичная концентрация дисперсной системы,
- частичная концентрация дисперсной системы, 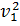 - объем частицы, k – константа, зависящая от показателей преломления дисперсной фазы и дисперсионной среды. Значения k определяется по формуле
- объем частицы, k – константа, зависящая от показателей преломления дисперсной фазы и дисперсионной среды. Значения k определяется по формуле
 ,
,
где n – показатель преломления дисперсной фазы, n0 – показатель преломления дисперсионной среды.
Если сравнить лиозоли и аэрозоли, то разность показателей преломления дисперсионной среды n0, определяется как  , для последних имеет большое значение. Расчеты показывают, что с ростом
, для последних имеет большое значение. Расчеты показывают, что с ростом  значение k тоже возрастает. По этому при одинаковых размерах и концентрация частиц аэрозоли более интенсивно рассеивают свет, чем лиозоли.
значение k тоже возрастает. По этому при одинаковых размерах и концентрация частиц аэрозоли более интенсивно рассеивают свет, чем лиозоли.
Электрические свойства.
В отсутствии специфической адсорбции частицы дисперсной фазы имеют небольшой заряд – до 100 элементарных зарядов. При специфической адсорбции ионов из газовой фазы на частицах дисперсной фазы электрический потенциал может достигнуть до 250 мВ.
Если аэрозольные частицы образуются конденсационным путем, то электрический заряд на частицах может появиться двумя способами:
· Конденсацией пересыщенных паров на ионах газовой фазы;
· Путем захвата незаряженными частицами ионов из газовой фазы.
У деспиргационных частиц заряд обычно возникает в процессе их образования в результате появления различных эффектов:
- баллоэлектрического эффекта – образования зарядов за счет трения в процессе разбрызгивания жидкости;
- трибоэлектрического эффекта – возникновения зарядов за счет трения в процессе распыления порошков;
- фотоэффекта – при облучении частиц аэрозоля.
Если частицы аэрозоля получают методом, который сочетает последовательно процессы испарения и конденсации, то заряды могут возникать в результате покидания частиц дисперсной фазы электронов или ионов при высокой температуре – термоэлектронной или термоионной эмиссии.
Устойчивость аэрозолей.
В аэрозолях единственным фактором устойчивости выступает энтропийный фактор. По этому устойчивость их может быть обеспечена только за счет факторов кинетической устойчивости – броуновского движения и диффузии. Коэффициент диффузии частицы определяется как

Из формулы видно, что на величину D влияют вязкость  и радиус частицы r. Вязкость газов примерно в 103 раз ниже, чем у жидкостей. По этому в аэрозолях диффузия и броуновское движение происходят более интенсивно.
и радиус частицы r. Вязкость газов примерно в 103 раз ниже, чем у жидкостей. По этому в аэрозолях диффузия и броуновское движение происходят более интенсивно.
В то же время, низкая вязкость газовой фазы и значительная разность в плотностях дисперсной фазы и дисперсионной среды играют отрицательную роль в обеспечении устойчивости, так как, согласно уравнению Стокса, эти факторы способствуют увеличению скорости седиментации:

где  - скорость оседания частицы, r – радиус частицы,
- скорость оседания частицы, r – радиус частицы, 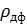 и
и  - плотности дисперсной фазы и дисперсионной среды,
- плотности дисперсной фазы и дисперсионной среды,  - ускорение силы тяжести,
- ускорение силы тяжести,  - динамическая вязкость дисперсионной среды.
- динамическая вязкость дисперсионной среды.
Снижения скорости седиментации и увеличения скорости броуновского движения можно добиваться путем уменьшения размера частиц. Седиментационно-дифузионное равновесие аэрозолях устанавливается при достижении диаметра частиц 50 нм.
При этом скорость седиментации составляет 2,23 * 10-3мм/с, а скорость броуновского движения достигает значения 2,1 * 10-3мм/с. Таким образом, при диаметре частиц меньше 50 нм аэрозоли обладают седиментационной устойчивостью. Однако есть и отрицательная сторона энтропийного фактора. С возрастанием степени дисперсности происходит увеличение свободной поверхности энергии. Это приводит к интенсификации процесса слипания частиц друг с другом особенно тех, которые имеют перечные размеры менее 50 нм.
Аэрозоли практически не обладают агрегативной устойчивостью и коагулируют очень быстро. Скорость коагуляции описывается уравнением Смолуховского:

В таблице 2 приведены значения периодов изменения концентрации в 100 раз.
Очевидно что аэрозоль не может иметь концентрацию выше 106-108 частиц в 1 см3.
Таблица 2