Методы окислительно-восстановительного титрования.
Окислительно - восстановительное титрование (редокс-метрия, оксидиметрия) – метод определения окислителей или восстановителей, основанный на использовании окислительно - восстановительных реакций, протекающих между определяемым веществом и титрантом (рабочим раствором).
Окислитель – вещество, которое принимает электроны.
Восстановитель – вещество, которое отдает электроны.
Реакция в общем виде:
n2Ox1 + n1Red2 = n2Red1 + n1Ox2
где
Ox1, Ox2 – окисленные формы титранта и определяемого вещества,
Red1, Red2 – восстановленные формы титранта и определяемого вещества с соответствующими коэффициентами.
Полуреакция восстановления в общем виде:
Ox + ze– = Red
Мерой окислительно-восстановительной способности вещества служит значение стандартного электродного потенциала: чем оно больше, тем и окислительные свойства проявляются сильнее.
Величину окислительно-восстановительного потенциала рассчитывают с помощью уравнения Нернста:
φок/вос= φ0ок/вос + 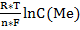
φок/вос= φ0ок/вос + 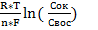 ,
,
где:
φок/вос- окислительно-восстановительный потенциал данной пары,В
φ0ок/вос- стандартный потенциал, В
R – газовая постоянная (R = 8,314 Дж);
T – абсолютная температура, К
n – количество отдаваемых или получаемых электронов в окислительно-восстановительном процессе;
F – постоянная Фарадея (F = 96484,56 Кл/моль);
C(Ме) – концентрация ионов металла, моль/л
Cок – концентрация (активность) окисленной формы, моль/л
Cвос– концентрация (активность) восстановленной формы, моль/л
Для стандартных условий
φ ок/вос= φ0 ок/вос + 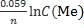
φ ок/вос = φ0ок/вос + 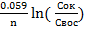 C
C
Значения стандартных окислительно-восстановительный потенциалов
Приведены в справочных таблицах
Все методы в окислительно-восстановительном титровании основаны на количественном окислении или восстановлении анализируемого вещества
Таблица 1
| Методы окислительно-восстановительного титрования. | ||||
| Название метода | Титрант | Уравнение полуреакции | Е0, в | |
| Перманганато- | KMnO4 | MnO4- + 8H+ + 5ē = Mn2+ + 4H2O | 1,51 | |
| метрия | ||||
| Броматометрия | KBrO3 | BrO3- + 6H+ + 6ē = Br- + 3H2O | 1,52 | |
| Цериметрия | Ce(SO4)2 | Ce+4 + ē = Ce+3 | 1,44 | |
| Хроматометрия | K2Cr2O7 | Cr2O72- + 14H+ + 6ē = 2Cr3+ + 7H2O | 1,33 | |
| Иодометрия | I2 | I2 + 2ē = 2I- | 0,54 | |
| Ванадатометрия | NH4VO3 | VO3- + 2H+ + ē = VO2- + H2O | 1,00 |





Название метода происходит от названия раствора титранта. В таблице представлены наиболее часто используемые в аналитической практике методы.
Молярная масса эквивалента окислителя (восстановителя)
Молярная масса эквивалента вещества (М(f экв х)) - масса одного эквивалента вещества; равная произведению фактора эквивалентности на молярную массу.
М(f экв (х) = f экв (х)*М(х)
где: М(f экв (х) - молярная масса эквивалента вещества х, г/моль.
f экв (х) - фактор эквивалентности
М(х) - молярная масса вещества х, г/моль
В окислительно-восстановительных реакциях фактор эквивалентности определяется по числу электронов, отданных или принятых в реакции одной молекулой (атомом) вещества окислителя или восстановителя.
f экв. окислителя восстановителя = 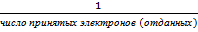
Пример
BrO3- + 6H+ + 6ē = Br- + 3H2O
f экв (KBrO3) = 1/6
М(1/6KBrO3) = 1/6* (39+80+3*16) =1/6*167 = 27,8 г/моль
Задание
Составить уравнения окислительно-восстановительных реакций методом электронного и ионно-электронного баланса (метод полуреакций)
Рассчитать молярную массу эквивалента окислителя.
1. Au + HNO3 + HC1  AuCl3 + NO +H2O
AuCl3 + NO +H2O
2.J2 + Cl2 + H2O  HJO3 + HC1
HJO3 + HC1
3.PH3 + KMnO4 + H2SO4  H3PO4 + MnSO4 + K2SO4 + H2O
H3PO4 + MnSO4 + K2SO4 + H2O
4.HNO2 + KMnO4 + H2SO4 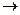 HNO3 + MnSO4 + K2SO4 + H2O
HNO3 + MnSO4 + K2SO4 + H2O
5.K2Cr2O7 + HCl 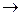 CrCl3 + Cl2 + KCl + H2O
CrCl3 + Cl2 + KCl + H2O