В качестве углеродного питания используют глюкозу, сахарозу, гидролизаты крахмала, мелассу, гирол. Кроме углеводов в качестве сырья могут быть использованы углеводороды (метан, этан, н-парафины нефти), а также уксусная, фумаровая кислоты и др.
В качестве источника азота используют мочевину в количестве 1,5 – 2,0%. Реже применяют как дополнительный к мочевине источник азота сульфат аммония (NH4)2SO4, хлорид аммония NH4Cl в количестве до 0,5% или водный раствор аммиака.
Для нормального роста культуры в среду необходимо вводить в десятых и сотых долях процента калий (в виде KH2PO4), магний (MgSO4*7Н2О), марганец (MnSO4*4H2O), а также мел.
Механизм биосинтеза
Процесс начинается с гидролиза сахарозы:
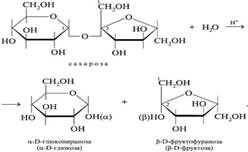
Фруктоза
Первой ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос остатка ортофостфата на глюкозу за счет АТФ. Образование глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы. Каталитическая активность фермента, гексокиназы, повышается в присутствии Mg2+. Переносчиком группы РО3Н2 является аденозинтрифосфат, который превращается в АДФ.

Второй рекцией является превращение глюкозо-6-фосфата под действием изомеразы во фруктозо-6-фосфат. Равновесная система состоит на 70-75% из фосфата глюкозы и на 30-25% из фосфата фруктозы.

Третья реакция катализируется ферментом фосфофруктокиназой; образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ:

Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента происходит расщепление на две фосфотриозы:
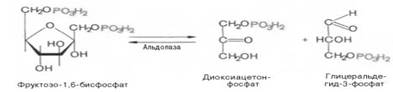
Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов.
Пятая реакция – это реакция изомеризации триозофосфатов. Катализируется ферментом триозофосфатизомеразой:

В результате шестой реакции глицеральдегид-3-фофат в присутствии фермента дегидрогеназы, кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-биофосфоглицериновой кислоты и восстановленной формы НАД (НАДН):
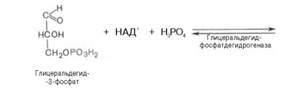
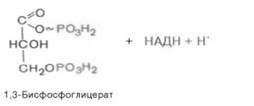
1,3-Биофосфоглицерат представляет собой высокоэнергетическое соединение. Механизм действия дегидрогеназы сводится к следующему: в присутствии неорганического фосфата НАД+ выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН глицеральдегид-3-фосфат связывается с молекулой фермента за счет SН-групп последнего. Образовавшаяся связь богата энергией, но она непрочная и расщепляется под влиянием неорганического фосфата, при этом образуется 1,3-биофосфоглицериновая кислота.
Седьмая реакция катализируется фосфоглицераткиназой, при этом происходит передача богатого энергией фосфатного остатка на АДФ с образованием АТФ и 3-фосфоглицериновой кислоты:

Т.о., благодяря действию двух ферментов (глицеральдегидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ. В отличие от окислительного фосфорилирования образование АТФ из высокоэнергетических соединений называется субстратным фосфорилированием.
Восьмая реакция сопровождается внутримолекулярным переносом оставшейся фосфатной группы, и 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту. Реакция легкообратима, протекает в присутствии ионов магния:

Девятая реакция катализируется ферментом енолазой, при этом 2-фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту, а фосфатная связь в положении 2 становится высокоэргической. Енолаза активируется катионами Mg2+ и Mn2+ и ингибируется фторидом.

Десятая реакция характеризуется разрывом выскоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на АДФ. Катализируется ферментом пируваткиназой:

Для дествия пируваткиназы необходимы Mg2+, а также одновалентные катионы щелочных металлов.
В результате одиннадцатой реакции пируват под влиянием пируваткарбоксилазы и при участии СО2 и АТФ карбоксилируется с образованием оксалоацетата:

Двенадцатая реакция катализируется ферментом цитрат-синтетазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота:

Ацетил-КоА Оксалоацетат Цитрат
Тринадцатая реакция – дегидратация лимонной кислоты с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту. Катализирует эти обратимые реакции гидратации-дегидратации фермент аконитатгидратаза. В результате происходит взаимоперемещение Н и ОН в молекуле цитрата:
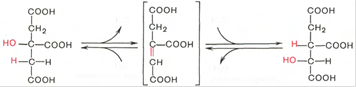
В результате четырнадцатой реакции происходит образование α-кетоглутарата. Изоцитрат дегидрируется в присутствии НАД-зависимой изоцитратдегидрогеназы. В ходе реакции изоцитрат одновременно декарбоксилируется. НАД-зависимый фермент является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Mg2+ и Mn2+. Происходит выделение CO2.

В ходе пятнадцатой реакции – ферментативного восстановительного аминирования α-кетоглутаровой кислоты НАДФ-зависимой глутаматдегидрогеназой – образуется глутаминовая кислота:
НООС – СН2 – СН2 – СО – СООН + НАД(Ф)Н2 + NН3 →
НООС – СН2 – СН2 – NН2СН – СООН + НАД(Ф).
В ходе рассмотренных реакций видно, что для нормального протекания синтеза глутамата необходимо наличие в субстрате неорганического фосфорного питания, а также макро- и микроэлементов К, Mg, Mn, активирующих ферменты.
Сверхсинтез кислоты у дикого штамма возможен в специальных физиологических условиях при торможении скорости роста и увеличении проницаемости клеточной мембраны для глутаминовой кислоты. Такие условия обеспечивает определенная концентрация биотина в среде (1 – 5 мкг/л), а также присутствие некоторых антибиотиков. Внутриклеточная концентрация глутамата снижается в результате экскреции продукта в околоклеточную среду, поэтому регуляция синтеза конечным продуктом ослабевает.
Также для осуществления процесса биосинтеза глутаминовой кислоты с высоким выходом используют мутанты с нарушенной ферментативной системой превращения кетоглутаровой кислоты в янтарную (отсутствие или дефект кетоглутаратдегидрогеназы).

Рис. 3: Схема синтеза глутаминовой кислоты C. Glutamaticum.
Шестнадцатая реакция – образование глутамата натрия. Для этого раствор глутаминовой кислоты нейтрализуют 45-50% раствором едкого натра.
Условия биосинтеза
На биосинтез глутамата оказывают стимулирующее влияние биотин, тиамин и некоторые антибиотики (пенициллин, тетрациклин), спирты и ПАВ. Однако концентрацию биостимуляторов следует строго контролировать, так как при высокой концентрации, например, биотина, усиливается рост биомассы, но снижается выход глутаминовой кислоты (рис. 4). Также при избытке биотина и недостаточной аэрации образуются аланин и молочная кислота, что связано с потерями углеводов.
Процесс биосинтеза осуществляют в строго асептических усло-виях в ферментаторах объемом 50 м3 с коэффициентом заполнения аппарата 0,7 в течение 48-52ч интенсивной аэрации. Температуру культивирования на всех стадиях поддерживают постоянной на уровне 28-30оС. В течение всего процесса рН среды поддерживается на уровне 7,0-7,2.