Лекция №2.3.1. «Кислородсодержащие органические соединения. Спирты.Фенолы».
Спирты (алкоголи) — это производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп — ОН у насыщенных атомов углерода.
Общая формула спиртов: R(OH) т,m ≥ 1,
где R— УВ радикал; т — число функциональных гидроксильных групп—ОН, которое определяет атомность спирта.
 |
 Классификация спиртов по атомности:
Классификация спиртов по атомности:
1. Одноатомные
2. Многоатомные (Двухатомные (диолы) Трехатомные(триолы)
Классификация спиртов по строению УВ радикала:

 Спирты
Спирты
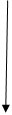
ПредельныеАроматические

 Непредельные
Непредельные
Алкенолы Алкинолы
ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ
(АЛКАНОЛЫ)
Предельные или насыщенные одноатомные спирты являются производными предельных углеводородов с одной гидроксильной группой.
Общая формула: СnН2n+1ОН, n ≥1
Гомологический ряд
| Формула спирта | Название спирта | |
| Заместительная номенклатура | Радикально-функциональная номенклатура | |
| СН3ОН | Метанол | Метиловый спирт |
| C2Н5ОН | Этанол | Этиловый спирт |
| С3Н7ОН | Пропанол | Пропиловый спирт |
| С4Н9ОН | Бутанол | Бутиловый спирт |
| С5Н11OH | Пентанол | Амиловый спирт |
| С6H13OH | Гексанол | Гексиловый спирт |
| С7Н15ОН | Гептанол | Гептиловый спирт |
| С8Н17ОН | Октанол | Октиловый спирт |
| С9Н190Н | Нонанол | Нониловый спирт |
| С10Н21ОН | Деканол | Дециловый спирт |
Химические свойства.
Химические свойства алканолов определяются особенностями их электронного строения: наличием в их молекулах полярных связей О—Н,
С—О, С—Н. Для алканолов характерны реакции, которые идут с расщеплением этих связей: реакции замещения, отщепления, окисления.
Реакции замещения.
1.Замещение атома водорода гидроксильной группы вследствие разрыва связи О-Н.
а) Взаимодействие с активными металлами с образованием алкоголятов (алканолятов) металлов:
2С2Н5О[Н + 2Na→2C2H5ONa+ Н2↑
Этанолят натрия
Эти реакции протекают только в безводной среде; в присутствии воды алкоголяты полностью гидролизуются:
C2H5ONa+ Н20 → С2Н5ОН + NaOH
б) Взаимодействие с органическими и неорганическими кислотами с образованием сложных эфиров (реакции этерификации):
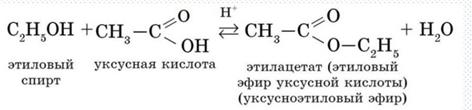
СН3ОН + НОNO2↔CH3-O-NO2+H2O
Метиловый эфир
азотной кисоты
Реакции этерификации являются обратимыми реакциями.
Реакции отщепления.
1.Дегидратация, т. е. отщепление воды
Дегидратация спиртов может быть двух типов: межмолекулярная и внутримолекулярная.
а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R—О—R'. Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов:
H2S04 (КОНЦ.), 140°С
 С2Н5О[Н+НО]С2Н5 С2Н5-О-С2Н5+Н2О
С2Н5О[Н+НО]С2Н5 С2Н5-О-С2Н5+Н2О
Диэтиловый эфир
H2S04 (КОНЦ.), 140°С
CH3O[H+HO]C2H5  CH3-O-C2H5+H2O
CH3-O-C2H5+H2O
Метилэтиловый эфир
Реакции окисления.
Горение (полное окисление)
Спирты горят на воздухе с выделением большого количества тепла (на этом основано использование спиртовок):
С2Н5ОН + 302 Л 2С02 + ЗН20; АН = -1374 кДж
2.Неполное окисление под действием окислителей: кислорода воздуха в присутствии катализаторов (например, Си), перманганата калия, дихромата калия и др.
Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования:
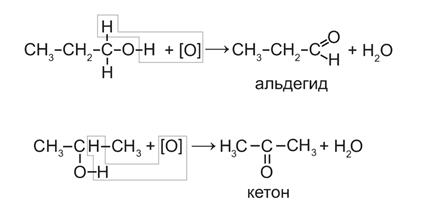
Таким образом, реакции дегидрирования спиртов по своей химической сущности являются реакциями окисления.