Процессы
Раздел I
Уравняйте окислительно-восстановительные реакции, используя метод электронно-ионного баланса. Укажите в реакции вещество-окислитель и вещество-восстановитель.
1. Na2SO3(p) + KMnO4(p) + H2SO4(p) ® Na2SO4(p) + MnSO4(p) +K2SO4(p) + H2O.
2. KI(р) + KIO3(р) + H2SO4(p) ® I2 + K2SO4(p) + H2O.
3. K2Cr2O7(p) + Na2SO3(p) + H2SO4(p) ® Cr2O3(т) + К2SO4(p) + Na2SO4(p) + H2O.
4. FeSO4(p) + KMnO4(p) + H2SO4(p) ® Fe2(SO4)3(p) + MnSO4(p) + K2SO4 + H2O.
5. NaCrO2(p) + Br2(г) + NaOH(p) ® Na2CrO4(p) + NaBr(p) + H2O.
6. Na2SO3(p) + KMnO4(p) + H2O ® Na2SO4(p) + MnO2(т) + KOH.
7. K2MnO4+ + Cl2(г) ® KMnO4(p) + KCl(p).
8. Al(т) + KNO3(p) + KOH(p) +H2O ® KAlO2(p) + NH3(г).
9. PbS(т) + HNO3(pазб) ® PbSO4(p) + NO(г) + H2O.
10. KCrO2(p) + Br2(г) + KOH(p) ® K2CrO4(p) + KBr(p) + H2O.
11. Cr2O3(т) + KOH(p) + KClO3(p) ® K2CrO4(p) + KCl(p) + H2O.
12. K2MnO4(p) + H2O ® KMnO4(p) + MnO2(т) + KOH(p).
13. H2S(г) + HNO3(p) ® H2SO4(p) + NO(г) + H2O.
14. H3AsO3(p) + KMnO4(p) + H2SO4(p) ® H3AsO4(p) + MnSO4(p) + K2SO4(p) + H2O.
15. NaNO2(p)+KMnO4(p)+H2SO4(p)®NaNO3(p)+MnSO4(p) + K2SO4(p) + H2O.
16. K2Cr2O7(p) + H2S(г) + H2SO4(p) ® Cr2(SO4)3(p) + S(т) + K2SO4(p) + H2O.
17. K2Cr2O7(p) + H2SO4(p) + SO2(г) ® K2SO4(p) + Cr2(SO4)3(p) + H2O.
18. P(т) + HNO3(p) + H2O ® H3PO4(p) + NO(г).
19. Cl2(г) + NaOH(p) ® NaClO3(p) + NaCl(p) + H2O.
20. Na2SO3(p) + KMnO4(p) + KOH(p) ® Na2SO4(p) + K2MnO4(p) + H2O.
21. KI(p) + KMnO4(p) + H2SO4(p) ® I2(г) + MnSO4(p) + K2SO4(p) + H2O.
22. Au(т) + HNO3(p) + HCl(p) ® HAuCl4(p) + NO(г) + H2O.
23. P(т) + HIO3(p) + H2O ® H3PO4(p) + HI(p).
24. KI(p) + HNO3(p) ® HIO3(р) + KNO3(р) + NO.
25. KMnO4(p) + H2O2(p) + H2SO4(p) ® MnSO4(p) + K2SO4(p) +O2(г) + H2O.
26. KMnO4(р) + H3PO3(р) + H2SO4(р) ® MnSO4(р) + H3PO4(р) + K2SO4(р) + H2O.
27. KI(р) + KIO3(р) + H2SO4(р) ® I2(г) + K2SO4(р) + H2O.
28. KNO2(р) + KI(р) + H2SO4(р) ®K2SO4(з) + I2(г) + NO(г) + H2O.
29. Ge(т) + HNO3(р) ® GeO2(т) + NO(г) + H2O.
30. Pb(т) + HNO3(разб) ® Pb(NO3)2(р) + NO(г) + H2O.
Раздел II
Уравняйте полуреакции методом электронно-ионных уравнений. Определите молярную массу эквивалентов окислителя или восстановителя в следующих полуреакциях:
1. HNO2 + … ® N2 + H2O.
2. N2 + ¼ ® NH4+.
3. HBrO + ¼ ® Br- + H2O.
4. WO2 + ¼ ® W + H2O.
5. WO3 + ¼ ® W + H2O.
6. Ag2O + ¼ ® Ag + OH-.
7. O2 + ¼ ® OH-.
8. O3 + ¼ ® O2 + OH-.
9. SiO2 + ¼ ® Si + H2O.
10. H2O2 + ¼ ® H2O.
11. H3AsO4 + ¼ ® HAsO2 + H2O.
12. HAsO2 + ¼ ® As + H2O.
13. NH3 + ¼ ® NO3- + H2O.
14. Al + ¼ ® AlO2- + H2O.
15. Br2 + ¼ ® BrO3- + H+.
16. W + ¼ ® WO42- + H2O.
17. Au + ¼ ® [AuCl4]-.
18. I2 + ¼ ® IO3- + H+.
19. I2 + ¼ ® HIO + H+.
20. H2O2 + ¼ ® O2 + H2O.
21. Si + ¼ ® SiO32- + H2O.
22. MnO2 + ¼ ® MnO4- + H+.
23. As + ¼ ® HAsO2 + H+.
24. HAsO2 + ¼ ® H3AsO4 + H+.
25. Pb2+ + ¼ ® PbO2 + H+.
26. Pb + ¼ ® Pb(NO3)2 + H2O.
27. MnO4- + ¼ ® MnO2 + H2O.
28. HNO3 + ¼ ® NO + H2O.
29. MnO42- + ¼ ® MnO2(т) + OH-.
30. H2S + ¼ ® SO42- + H+.
Раздел III
Определите направления протекания окислительно-восстановительных процессов.
При расчетах следует иметь в виду, что значения всех стандартных электродных потенциалов (j°) окислительно-восстановительных пар (редокс-пар) даны для полуреакций восстановления.
Определите, какое вещество в приведенных ниже парах веществ является более сильным окислителем:
1. HNO2; Br2 ( = 1,004 B;
= 1,004 B; 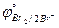 = 1,087 B).
= 1,087 B).
2. HNO3; Bi3+ ( = 0,838 B;
= 0,838 B;  = 0,317 B).
= 0,317 B).
3. Cu2+; Fe3+ (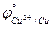 = 0,158 B;
= 0,158 B;  = 0,771 B).
= 0,771 B).
4. HNO3; I2 ( = 0,880 B;
= 0,880 B; 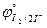 = 0,535 B).
= 0,535 B).
5. HNO3; HClO (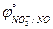 = 0,955 B;
= 0,955 B;  = 1,494 B).
= 1,494 B).
6. N2, Fe3+ ( = 0,26 В;
= 0,26 В;  = 0,771 В).
= 0,771 В).
Определите, какое вещество является более сильным восстановителем:
7. Mg или Zn ( = -2,370 B;
= -2,370 B;  = -0,763 B).
= -0,763 B).
8. H2S или H2 (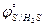 = 0,144 B;
= 0,144 B;  = 0,000 B).
= 0,000 B).
9. SO2 или Cl2 ( = 0,159 B;
= 0,159 B;  = 0,476 B).
= 0,476 B).
10. H2O2 или Cr ( = 0,694 B;
= 0,694 B;  = -0,852 B).
= -0,852 B).
11. Pb или MnO2 (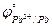 = -0,126 B;
= -0,126 B;  = 0,621 B).
= 0,621 B).
12. Fe или MnO2 ( = 0,44 В;
= 0,44 В;  = 0,621 В).
= 0,621 В).
Определите, можно ли окислить первым из указанных в каждой паре веществом второе вещество:
13. HClO; Au ( = 1,630 B;
= 1,630 B; 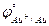 = 1,691 B).
= 1,691 B).
14. MnO4-; Au ( = 1,531 B;
= 1,531 B;  = 1,498 B).
= 1,498 B).
15. Cl2(г); Ag ( = 1,358 B;
= 1,358 B;  = 0,779 B).
= 0,779 B).
16. O2(г); Hg(ж) ( = 0,694 B;
= 0,694 B;  = 0,852 B).
= 0,852 B).
17. SO42-; P(кр.)
(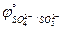 = -0,932 B;
= -0,932 B;  = 0,383 B).
= 0,383 B).
18. HBrO, Au ( = 1,35 В;
= 1,35 В;  = 1,42 В).
= 1,42 В).
19. WO2, As (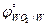 = -0,05 В;
= -0,05 В;  = -0,54 В).
= -0,54 В).
20. BrO3-; IO3- ( = 0,60 В;
= 0,60 В;  = 0,26 В).
= 0,26 В).
Определите, можно ли осуществить следующие реакции:
21. Между Fe3+ и Сu с образованием ионов Fe2+ и Сu2+
( = 0,771 B;
= 0,771 B;  = 0,338 B).
= 0,338 B).
22. Между Fe и Сu2+ с образованием Cu
( = -0,441 B;
= -0,441 B;  = 0,338 B).
= 0,338 B).
23. Между KNO2 и KI с образованием I2
( = 1,203 B;
= 1,203 B; 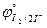 = 0,535 B).
= 0,535 B).
24. Между KNO2 и КMnO4 с образованием KNO3 и MnSO4
( = 0,838 B;
= 0,838 B;  = 1,531 B).
= 1,531 B).
25. Между Na и Cl2 с образованием NaCl
( = -2,711 B;
= -2,711 B;  = 1,358 B).
= 1,358 B).
26. Между HClO и H2S с образованием элементарной серы (S)
( = 1,494 B;
= 1,494 B; 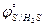 = 0,144 B).
= 0,144 B).
27. Между Na+ и Cl- c образованием Na и Cl2
( = -2,711 B;
= -2,711 B;  = 1,358 B).
= 1,358 B).
28. Между Al и очень разбавленной HNO3 c образованием Al3+ и NH4NO3
( = -1,700 B;
= -1,700 B;  = 0,880 B).
= 0,880 B).
29. Между Au и разбавленной HNO3 с образованием газообразного NO
( = 1,498 B;
= 1,498 B; 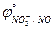 = 0,955 B).
= 0,955 B).
30. Между PbS и H2O2 с образованием Н2О и PbSO4
( = 0,304 B;
= 0,304 B;  = 1,764 B).
= 1,764 B).
Электрохимические процессы
Раздел I
1. Вычислите электродный потенциал системы Cu|CuSO4(0,1M) при температуре 25 °С.
2. Вычислите электродный потенциал системы Ni|NiSO4(0,01M) при температуре 25 °С.
3. Вычислите электродный потенциал системы Fe|FeCl2(0,001M) при температуре 25 °С.
4. Вычислите электродный потенциал системы Zn|ZnSO4(0,01М) при температуре 25 °С.
5. Вычислите электродный потенциал системы Cd|CdCl2(0,001М) при температуре 25 °С.
6. Вычислите электродный потенциал водородного электрода в растворе с молярной концентрацией ионов водорода, равной 0,01 моль/л, при температуре 25 °С.
7. Вычислите электродный потенциал хлорного электрода в растворе с молярной концентрацией ионов хлора, равной 0,001 моль/л, при температуре 25 °С.
8. Вычислите электродный потенциал кислородного электрода в растворе с молярной концентрацией ионов водорода, равной 0,001 моль/л, при температуре 25 °С.
9. Вычислите электродный потенциал системы Ni|NiSO4(0,25M) при температуре 25 °С, если кажущаяся степень диссоциации сульфата никеля равна 40 %.
10. Вычислите электродный потенциал системы Cu|CuSO4(0,2М), если кажущаяся степень диссоциации сульфата меди при температуре 25 °С равна 50 %.
11. Электродный потенциал цинкового электрода в 0,2М растворе сульфата цинка при температуре 25 °С равен -0,7905 В. Определите кажущуюся степень диссоциации сульфата цинка в этом растворе.
12. Электродный потенциал системы Cu|CuSO4(0,25M) при температуре 25 °С равен 0,3075 В. Чему равна кажущаяся степень диссоциации сульфата меди в этом растворе?
13. Вычислите электродный потенциал водородного электрода в растворе с молярной концентрацией гидроксид-ионов, равной 0,001 моль/л, при температуре 25 °С.
14. Вычислите электродный потенциал кислородного электрода в растворе с молярной концентрацией гидроксид-ионов, равной 0,001 моль/л, при температуре 25 °С.
15. Определите концентрацию ионов водорода в растворе, в котором электродный потенциал водородного электрода равен -0,177 В при температуре 25 °С.
16. Определите концентрацию ионов хлора в растворе, в котором электродный потенциал хлорного электрода при температуре 25 °С равен 1,299 В.
17. Вычислите электродный потенциал водородного электрода в растворе с рН=12 при температуре 25 °С.
18. Вычислите электродный потенциал кислородного электрода в растворе с рН=10 при температуре 25 °С.
19. Электродный потенциал водородного электрода в 0,002М растворе соляной кислоты при температуре 25 °С равен -0,177 В. Чему равна кажущаяся степень диссоциации соляной кислоты в указанном растворе?
20. Электродный потенциал водородного электрода в 0,0002М растворе гидроксида натрия при температуре 25 °С равен -0,59 В. Чему равна кажущаяся степень диссоциации гидроксида натрия в указанном растворе.
21. Электродный потенциал кислородного электрода в 0,025М растворе серной кислоты при температуре 25 °С равен 1,109 В. Чему равна кажущаяся степень диссоциации серной кислоты в указанном растворе.
22. Электродный потенциал кислородного электрода в 0,025М растворе гидроксида калия при температуре 25 °С равен 0,519 В.Чему равна кажущаяся степень диссоциации гидроксида калия в указанном растворе.
23. Электродный потенциал алюминиевого электрода в растворе сульфата алюминия при температуре 25 °С равен -1,6817 В. Какова молярная концентрация сульфата алюминия, если кажущаяся степень диссоциации соли равна 0,5.
24. Вычислите электродный потенциал системы Cu|CuSO4(0,04н) при температуре 25 °С, если кажущаяся степень диссоциации сульфата меди равна 0,5.
25. Вычислите электродный потенциал системы Ni|NiSO4(0,5н) при температуре 25 °С если кажущаяся степень диссоциации сульфата никеля равна 40 %.
26. Вычислите электродный потенциал свинцового электрода в насыщенном растворе бромида свинца, если концентрация ионов брома в растворе равна 0,009 моль/л, а ПР(PbBr2) = 8,1×10-6.
27. Электродный потенциал системы Pt,H2|NaOH(x моль/л) при температуре 25 °С равен -0,767 В. Какова молярная концентрация эквивалентов едкого натра, если степень диссоциации гидроксида натрия в растворе равна 1.
28. Электродный потенциал системы Pt,H2|HCl(x моль/л) при температуре 25 °С равен -0,118 В. Какова молярная концентрация эквивалентов соляной кислоты, если степень диссоциации соляной кислоты в растворе равна 1.
29. Вычислите электродный потенциал системы Zn|ZnSO4 (0,002н) при температуре 25 °С.
30. Вычислите электродный потенциал системы Al|Al2(SO4)3 (0,006н) при температуре 25 °С, если кажущаяся степень диссоциации сульфата алюминия равна 50 %.
Раздел II
1. Какова ЭДС гальванического элемента, состоящего из водородного и кислородного электродов, в растворе с рН=3 при температуре 25 °С?
2. Вычислите константу равновесия реакции, протекающей в гальваническом элементе, состоящем из двух водородных электродов, в растворе с рН=4 и рН=10 при температуре 25 °С?
3. Какова ЭДС гальванического элемента, состоящего из кислородных электродов, в растворах с рН=5 и рН=12 при температуре 25 °С?
4. ЭДС гальванического элемента, состоящего из водородного электрода и электрода, имеющего потенциал 0,285 В, равна 0,429 В при температуре 25 °С. Вычислите рН раствора.
5. ЭДС гальванического элемента, составленного из кислородного электрода и электрода, имеющего потенциал 0,25 В, равна 0,299 В при температуре 25 °С. Вычислите рН раствора.
6. Вычислите ЭДС гальванического элемента
Fe|FeSO4(0,1M)||(0,01н)NaOH|H2, Pt, при температуре 25 °С.
7. Гальванический элемент состоит из железа, погруженного в раствор его соли с концентрацией ионов Fe2+ 0,001М, и меди, погруженной в раствор ее соли. Какой концентрации должен быть раствор соли меди, чтобы ЭДС стала равна нулю?
8. Чему равна ЭДС гальванического элемента
Cd|Cd(NO3)2(0,01M)||(0,1M)AgNO3|Ag при температуре 25 °С?
9. Какой должна быть концентрация ионов меди в растворе, чтобы гальванический элемент Zn|ZnSO4||CuSO4|Cu при концентрации ионов цинка, равной 0,01 моль/л, давал при температуре 25 °С ЭДС = 1,0983 В?
10. ЭДС гальванического элемента, составленного из кислородного электрода в растворе соляной кислоты и электрода, имеющего потенциал 0,785 В, равна 0,265 В при температуре 25 °С. Вычислите рН раствора соляной кислоты.
11. ЭДС гальванического элемента, составленного из водородного электрода в растворе гидроксида натрия и электрода, имеющего потенциал -0,250 В, равна 0,370 В при температуре 25 °С. Вычислите рН раствора гидроксида натрия.
12. Какова ЭДС гальванического элемента, состоящего из водородного и кислородного электродов, в растворе с рН=11?
13. Вычислите ЭДС гальванического элемента
Zn|ZnCl2(0,2н)||(0,01M)CuSO4|Cu при температуре 25 °С.
14. Какой должна быть концентрация ионов серебра в растворе, чтобы гальванический элемент
Pb|Pb(NO3)2(0,02н)||(x моль/л)AgNO3|Ag при температуре 25 °С давал ЭДС = 0,984 В?
15. Вычислите ЭДС гальванического элемента
Al|Al2(SO4)3(0,05M)||(0,01M)NiSO4|Ni при температуре 25 °С.
16. ЭДС концентрационного гальванического элемента, составленного из двух никелевых электродов, при температуре 25 °С равна 0,059 В. Концентрация ионов никеля в растворе около отрицательного электрода равна 0,001 моль/л. Определите концентрацию ионов никеля около положительного электрода.
17. ЭДС цепи Zn|ZnSO4(0,1н)||(x н)CuSO4|Cu равна 1,1275 В при температуре 25 °С. Определите концентрацию ионов меди и молярную концентрацию эквивалентов сульфата меди, если a=0,5.
18. Какой должна быть концентрация ионов олова в растворе, чтобы гальванический элемент Zn|ZnSO4||SnSO4|Sn при Сэк(Zn2+)=0,02 моль/л давал ЭДС = 0,655 В при температуре 25 °С?
19. Вычислите ЭДС гальванического элемента
Zn|ZnSO4(0,01M)||(0,2н)CuSO4|Cu при температуре 25 °С.
20. Вычислите ЭДС гальванического элемента
Mn|MnSO4(0,1M)||(0,2н)ZnSO4|Zn при температуре 25 °С.
21. Какой должна быть концентрация ионов цинка в растворе, чтобы элемент Mg|MgCl2||ZnCl2|Zn при Сэк(Mg2+)=0,2 моль/л давал при температуре 25 °С ЭДС = 1,602 В?
22. Вычислить ЭДС гальванического элемента
Al|Al2(SO4)3(0,003н)||(0,1M)NiSO4|Ni при температуре 25 °С.
23. Какова ЭДС гальванического элемента при температуре 25 °С, состоящего из водородного электрода в растворе с рН=3 и кислородного электрода в растворе с рН=12?
24. Какова ЭДС гальванического элемента при температуре 25 °С, состоящего из водородного электрода в растворе с рН=5 и медного электрода в 0,1М растворе сульфата меди?
25. Какова ЭДС гальванического элемента при температуре 25 °С, состоящего из кислородного электрода в растворе с рН=5 и медного электрода в 0,1М растворе сульфата меди?
26. ЭДС гальванического элемента, образованного никелем, погруженным в 0,0001М раствор его соли, и серебром, погруженным в раствор его соли, равна 1,108 В. Определите молярную концентрацию ионов Ag+ в растворе его соли.
27. Вычислите ЭДС гальванического элемента, образованного магнием и цинком, погруженными в растворы их солей с концентрациями ионов Mg2+ и Zn2+ 1,8·10-5М и 2,5·10-2М соответственно.
28. Вычислите ЭДС гальванического элемента
Mg|MgSO4(0,02н)||(0,002н)Pb(NO3)2|Pb при температуре 25 °С.
29. Вычислите ЭДС гальванического элемента
Al|AlCl3(0,001M)||(0,01M)CuSO4|Cu при температуре 25 °С.
30. Какова ЭДС гальванического элемента, состоящего из водородного и кислородного электродов в растворе с рН=7 при температуре 25 °С.
Раздел III
1. Какое количество воды разложится при пропускании через раствор сульфата натрия тока силой 5 А в течение 2 часов?
2. Сколько времени потребуется для разложения 1 моль воды током силой 5 А?
3. Какое количество металла выделится на катоде при протекании через раствор сульфата никеля в течение 10 мин постоянного тока силой 5 А?
4. Какое количество электричества необходимо для выделения (н.у.) 0,112 л водорода при электролизе водного раствора сульфата натрия?
5. Определите количество выделенной на катоде меди, если через раствор хлорида меди пропускать ток силой 3 А в течение 6 часов.
6. Какой объем водорода, измеренный при нормальных условиях, выделится на катоде при пропускании через раствор хлорида натрия тока 5 А в течение 1 часа?
7. Сколько времени нужно пропускать ток силой 2 А через 0,1н раствор сульфата накеля, чтобы полностью выделить никель из 500 мл раствора? Выход по току равен 90 %.
8. Сколько граммов цинка выделилось на катоде при электролизе водного раствора сульфата цинка, если на аноде выделилось 250 мл кислорода, измеренного при нормальных условиях? Выход по току цинка составляет 80 %.
9. Вычислите количество хлора, выделившееся на аноде при пропускании тока силой 3 А в течение 6 часов.
10. Какова была сила тока при электролизе, если за 50 минут выделилась вся медь из 120 мл 0,4н раствора сульфата меди?
11. Вычислите объем выделившегося на аноде кислорода, если через разбавленный раствор серной кислоты проходил ток силой 5 А в течение 1 часа.
12. Определите количество гидроксида натрия, которое образуется при электролизе водного раствора хлорида натрия при пропускании через электролит тока силой 3 А в течение 24 часов.
13. Сколько времени потребуется для разложения 1 моль расплава хлорида натрия током силой 2 А?
14. Вычислите массу разложившейся воды, если ток силой 5 А пропускали в течение 1 часа через разбавленный раствор серной кислоты.
15. Какое количество электричества необходимо пропустить через водные растворы хлорида железа (II) и хлорида железа (III), чтобы на катоде выделилось одинаковое количество железа?
16. Сколько граммов цинка выделится на катоде при электролизе водного раствора сульфата цинка, если через раствор пропускать ток силой 5 А в течение 20 минут?
17. Какое количество электричества надо пропустить через водный раствор хлорида натрия, чтобы получить 1 кг гидроксида натрия?
18. При электролизе водного раствора сульфата хрома (Cr2(SO4)3) током силой 1 А масса катода возросла на 10 г. Какое количество электричества и в течение какого времени было пропущено?
19. Сколько времени пропускали ток силой 8 А через водный раствор сульфата никеля, если масса никелевого анода уменьшилась на 0,8805 г?
20. Через водный раствор хлорида натрия пропускали ток силой 15 А в течение 16 минут. Сколько граммов гидроксида натрия образовалось у катода?
21. Через водный раствор сульфата натрия пропускали ток в течение 2 часов, в результате чего выделилось 2 л водорода, измеренного при нормальных условиях. Вычислите силу тока.
22. Через водный раствор сульфата некоторого металла пропускали ток силой 6 А в течение 45 минут, в результате чего на катоде выделилось 5,49 г металла. Найдите эквивалент металла.
23. При электролизе водного раствора сульфата меди на аноде выделилось 420 мл газа (н.у.). Вычислите количество вещества, выделившегося на катоде.
24. Сколько времени пропускали через водный раствор щелочи ток силой 3 А, если при этом выделилось 2,24 л кислорода, измеренного при нормальных условиях?
25. Какие вещества и в каком количестве выделяются на электродах, если через водный раствор нитрата серебра пропускали ток силой 2 А в течение 4 часов? Оба электрода выполнены из серебра.
26. Вычислите молярную массу эквивалентов железа, если при прохождении через раствор соли железа тока силой 5 А в течение 5,36 часа выделилось 27,9 г железа.
27. Какие вещества и в каком количестве образуются при пропускании тока силой 6 А в течение 1 часа через водный раствор гидроксида калия? Оба электрода угольные.
28. Какие вещества и в каком количестве выделяются при пропускании 48250 Кл электричества через водный раствор хлорида магния? Оба электрода угольные.
29. Сколько времени пропускали ток силой 10 А через водный раствор щелочи, если при этом было получено 8,4 л водорода, измеренного при нормальных условиях?
30. Через водные растворы сульфата никеля и сульфата свинца пропускали одно и то же количество электричества. На одном из катодов выделилось 25,9 г свинца. Сколько граммов никеля выделилось на другом катоде? Какой газ и в каком объеме (н.у.) выделился на каждом из анодов?
Приложение
Таблица П1
Изменение стандартных энтальпий при образовании данного вещества из простых веществ (ΔfH°) и стандартные значения энтропии (S°) при температуре 298 К
| Вещество | ΔfH°, кДж/моль | S°, Дж/(моль·К) | Вещество | ΔfH°, кДж/моль | S°, Дж/(моль·К) |
| Br2 (г) | 30,91 | 245,37 | Н2О (г) | -241,84 | 188,74 |
| Br2 (ж) | 152,21 | Н2О (ж) | -285,84 | 69,96 | |
| С (алм) | 1,83 | 2,37 | Н2О2 (ж) | -187,86 | 109,86 |
| С (граф) | 5,74 | HCl (г) | -92,30 | 186,70 | |
| СН4 (г) | -74,85 | 186,27 | H2S (г) | -20,60 | 205,70 |
| С2Н2 (г) | 226,75 | 200,82 | H2SO4 (ж) | -813,99 | 156,90 |
| С2Н4 (г) | 52,30 | 219,45 | MgCl2 (к) | -644,80 | 89,54 |
| С2Н6 (г) | -84,67 | 229,49 | N2 (г) | 191,50 | |
| СН3ОН (г) | -201,00 | 239,76 | NH3 (г) | -45,94 | 192,66 |
| СН3ОН (ж) | -238,57 | 126,78 | NH4Cl (к) | -314,22 | 95,81 |
| Cl2 (г) | 222,60 | N2O (г) | 82,01 | 219,83 | |
| СО (г) | -110,53 | 197,55 | NO (г) | 91,26 | 210,64 |
| СО2 (г) | -393,51 | 213,66 | NO2 (г) | 34,19 | 240,06 |
| COS (г) | -141,70 | 231,53 | N2O4 (г) | 11,11 | 304,35 |
| CS2 (ж) | 88,70 | 151,04 | NaCl (к) | -411,12 | 72,13 |
| Fe (к) | 27,15 | О2 (г) | 205,30 | ||
| Fe2O3 (к) | -822,16 | 87,45 | О3 (г) | 142,30 | 238,80 |
| Fe3O4 (к) | -1117,13 | 146,19 | Р (к) | 41,09 | |
| FeS2 (к) | -177,40 | 52,93 | РН3 (г) | 5,43 | 210,00 |
| Н2 (г) | 130,52 | Р2О5 (к) | -1507,20 | 140,30 | |
| HBr (г) | -36,38 | 198,58 | S (к) | 31,88 | |
| HI (г) | 26,36 | 206,48 | S2 (г) | 127,40 | 227,80 |
| HNO3 (ж) | -173,00 | 156,90 | SO2 (г) | -296,90 | 248,07 |
| SO3 (г) | -395,85 | 256,69 |
Таблица П2
Стандартные окислительно-восстановительные потенциалы при температуре 25 °С
| Электрод | Электродная реакция | Е0, В |
| Na+/Na | Na+ + e = Na | -2,714 |
| Mg2+/Mg | Mg2+ +2e = Mg | -2,363 |
| Al3+/Al | Al3+ + 3e = Al | -1,662 |
| Mn2+/Mn | Mn2+ + 2e = Mn | -1,180 |
| Zn2+/Zn | Zn2+ + 2e = Zn | -0,761 |
| Cr3+/Cr | Cr3+ + 3e = Cr | -0,740 |
| Fe2+/Fe | Fe2+ + 2e = Fe | -0,441 |
| Cd2+/Cd | Cd2+ +2e = Cd | -0,402 |
| Ni2+/Ni | Ni2+ + 2e = Ni | -0,236 |
| Sn2+/Sn | Sn2+ + 2e = Sn | -0,136 |
| Pb2+/Pb | Pb2+ + 2e = Pb | -0,126 |
| H+/H2,Pt | 2H+ + 2e = H2 | 0,000 |
| Cu2+/Cu | Cu2+ + 2e = Cu | 0,337 |
| OH-/O2,(pH=14) | O2 + 2H2O + 4e = 4OH- | 0,401 |
| I-/I2,Pt | I2 + 2e =2I- | 0,540 |
| Ag+/Ag | Ag+ + e = Ag | 0,799 |
| Br-/Br2,Pt | Br2 + 2e = 2Br- | 1,065 |
| MnO2/Mn2+ | MnO2 + 4H+ = Mn2+ +2H2O | 1,230 |
| Cl-/Cl2,Pt | Cl2 + 2e = 2Cl- | 1.358 |
| Ni2+/Ni3S2 | 3Ni2+ +2S + 6e = Ni3S2 | 1,400 |
| S2O82-/SO42- | S2O82- +2e = 2SO42- | 2,700 |
| F-/F2,Pt | F2 + 2e = 2F- | 2,870 |
Таблица П3
Перенапряжение выделения водорода и ионизации кислорода на различных металлах при температуре 25 °С (i = 0,1 А/дм2)
| Электрод | Перенапряжение, В | |
| водорода | кислорода | |
| Свинец | 1,05 | 1,44 |
| Цинк | 0,83 | 1,75 |
| Графит | 0,65 | 1,17 |
| Олово | 0,63 | 1,21 |
| Алюминий | 0,58 | – |
| Марганец | 0,50 | – |
| Медь | 0,48 | 1,05 |
| Золото | 0,44 | – |
| Железо | 0,36 | 1,07 |
| Серебро | 0,34 | 0,97 |
| Никель | 0,30 | 1,09 |
| Платина блестящая | 0,07 | 0,7 |