Окислительно - восстановительные реакции
В аналитической химии
Любая окислительно-восстановительная реакция состоит из двух полуреакций: одна полуреакция показывает превращение окислителя, другая – восстановителя. Например,
FeSO4 + KMnO4 + H2SO4 = MnSO4 + Fe2(SO4)3 +K2SO4 + H2O
MnO4- + 8H+ + 5e- → Mn2+ + 4 H2O; MnO4- -окислитель
Fe2+ -1e- → Fe3+; Fe2+ - восстановитель
В каждой полуреакции различают окисленную и восстановленную формы соединений, которые составляют редокс-пару: MnO4-/Mn2+, где MnO4- -окисленная форма (ox), Mn2+ - восстановленная форма соединения (red). Редокс-пара для второй полуреакции: Fe3+/ Fe2+ .
Обратите внимание, что окисленная форма содержит элемент в большей степени окисления, для элемента в восстановленной форме степень окисления меньше.
Химическую активность редокс пары характеризуют значения восстановительного потенциала (φ). Стандартные восстановительные потенциалы (φ0)измерены при стандартных условиях: aox = ared = 1 моль/л, Т = 298 К и парциальное давление каждого газа над раствором 101 кПа(1 атм). Это табличные величины, значения которых приведены в таблице 4. Окислитель содержится в левой части полуреакции восстановления, а восстановитель - в правой части. Чем больше значение восстановительного потенциала, тем более сильным окислителем является окисленная форма и слабым восстановителем – восстановленная форма.
Например: φ0(F2/F-) =2.87 В; φ(Cl2/Cl-) =1.36 В;
φ0(Br2/Br-) =1.05 В; φ(I2/I-) =0.54 В;
Cамым сильным окислителем является F2, а фторид-ион самым слабым восстановителем из галогенид-ионов.
Окислительно-восстановительная реакция протекает самопроизвольно в том направлении, для которого разность потенциалов полуреакций величина положительная (Δφ > 0). Это означает, что система с большим значением потенциала является окислителем по отношению к системе с меньшим значением потенциала.
Пример 4.1. В каком направлении пойдет реакция в водном растворе при стандартных условиях в системе:
FeCl3 + SnCl2 ↔ SnCl4 + FeCl2,
Решение: Запишем полуреакции восстановления и значения стандартных потенциалов:
Fe3+ + 1e- → Fe2+ φ0 = 0.77 В
Sn4+ + 2 e- → Sn2+ φ0 = 0.15 В
т.к. Δφ = 0,77 - 0,15 = 0,62 (Δφ > 0), т.е. реакция идет самопроизвольно слева направо (→)
Восстановительный потенциал отражает способность окисленной формы присоединять электроны и стремление восстановительной формы отдавать электроны. Эта способность зависит от природы вещества, температуры, характера среды, концентрации окисленной и восстановленной форм и описывается уравнением Нернста:
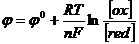
где φ0 - стандартный восстановительный потенциал, В
n – число электронов, участвующих в реакции,
R – молярная газовая постоянная (8,31 Дж/ моль·К
T – температура (К)
F – число Фарадея (~96500 Кл)
[ox] - концентрация окисленной формы, моль/л
[red] – концентрация восстановленной формы, моль/л.
Для расчетов используют приведенное к стандартным условиям уравнение Нернста:
φ = φ0 + 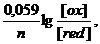
Поскольку в окислительно-восстановительной реакции принимают участие малорастворимые соединения, молекулы воды и концентрации этих веществ являются величинами постоянными, то они не включаются в логарифмический член уравнения Нернста. Для полуреакции:
↓MnO2 + 4H+ + 2e → Mn 2+ + 2 H2O
выражение для потенциала будет иметь вид:
φ = φ0 + 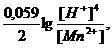
Если в окислительно-восстановительной реакции участвуют катионы водорода или гидроксид ионы, то концентрации этих ионов входят в логарифмический член уравнения Нернста в степенях равных их стехиометрическим коэффициентам в полуреакции:
.Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O
φ = φ0 + 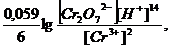
Cr3+ + 8OH‾ - 3e → CrO42- + 4H2O
φ = φ0 + 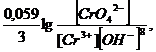
Выбирая среду для проведения реакции, следует учитывать ее влияние на окислительно-восстановительные процессы. Для создания кислой среды чаще всего используют разбавленную серную кислоту, а для создания щелочной среды применяют растворы KOH и NaOH
Пример 4.2. Рассмотрим как влияет среда на величину восстановительного потенциала, а значит на направление протекания окислительно-восстановительного процесса для системы:
AsO43- + 2I- + 2H+ ↔ AsO33- + I2 + H2O
Решение:
(I) AsO43- + 2H+ +2e- → AsO33- + H2O, φ0 = 0,57 В
(II) I2 + 2e- → 2I- φ0 = 0,54 В
1) Рассчитаем восстановительный потенциал для полуреакции (I) в сильнокислой среде при [H+] = 10 моль/л и [ox] = [red] = 1моль/л
φ = φ0 + 
Рассчитанное значение величины потенциала (0,63В) больше значения потенциала редокс-пары I2/2I- (0.54В) и реакция протекает в прямом направлении (→).
2) В слабощелочной среде в присутствии NaHCO3 (рН раствора ~ 8),
т.е. [H+] = 10-8 моль/л и значение потенциала равно:
φ = φ0 + 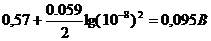
Величина потенциала значительно понизилась и реакция пойдет в обратном направлении, т.е. йод, будет окислять арсенит-ион.
Параллельно с окислительно-восстановительным процессом могут протекать и другие реакции (комплексообразование, образование осадка, протолитический процесс), которые влияют на окислительно-восстановительную способность редокс-пары.
Пример 4.3. Рассмотрим как изменяется значение восстановительного потенциала, если в процессе реакции образуется осадок. При добавлении к раствору соли меди (II) избытка йодида калия в кислой среде протекает реакция
Н2SO4
2Сu2+ + 4I- → 2CuI ↓ + I2
Cu2+ +1e- → Cu+, φ0 = 0.17 В
I2 + 2e- → 2I- , φ0 = 0,54 В
Решениие: Теоретически реакция должна протекать в обратном направлении поскольку значение потенциала редокс-пары I2/2I- больше потенциала редокс-пары Cu2+/Сu+ (при концентрациях всех веществ равных 1моль/л).
Практически химическое равновесие сдвинуто вправо и реакция протекает в прямом направлении. В выражение уравнения Нернста φ = φ0 + 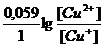 концентрация ионов меди (I) определяется величиной произведения растворимости йодида меди (I)
концентрация ионов меди (I) определяется величиной произведения растворимости йодида меди (I) 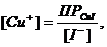 ПРCuI = [Cu+] [I-] = 10-12. Тогда
ПРCuI = [Cu+] [I-] = 10-12. Тогда
φ=φ0 + 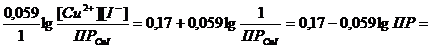
= 0,17 -0,059 lg 10-12 = 0.89 В.
Рассчитанное значение потенциала значительно превышает величину стандартного потенциала редокс-пары I2/2I- = 0,54 В, поэтому реакция протекает в прямом направлении (→) и применяется для количественного определения Cu2+ в растворе.
Пример 4.4. Можно ли провести окисление Fe2+ до Fe3+ действием галогенов: Cl2, Br2, I2.
Решение: По таблице стандартных восстановительных потенциалов находим φ0 для всех указанных систем:
φ0(Cl2 /2Cl-)= 1.36B; φ(Br2 /2Br-)= 1.05B; φ(I2 /2I-)= 0.54B;
φ0(Fe3+/Fe2+) = 0.77 В
Сравнивая потенциалы, видим, что только для редокс-пар хлора и брома величины потенциалов больше чем потенциал редох-пары (Fe3+/Fe2+), следовательно, только с помощью этих галогенов можно окислить железо(II ) до железа (III).
Пример 4.5. Рассчитать массу Na2SO3, необходимую для восстановления в кислой среде 100 мл раствора KClO3 c массовой долей ω = 10% и плотностью раствора ρ = 1,09 г/мл.
Решение: Запишем полуреакции, протекающие в этой системе:
1 ClO3 - + 6H+ +6e- → Cl- + 3H2O fЭ = 1/6

 3 SO32- + H2O - 2e- → SO42- +2H+ fЭ = 1/2
3 SO32- + H2O - 2e- → SO42- +2H+ fЭ = 1/2



 ClO3 - + 6H+ + 3SO32- + 3 H2O → Cl- + 3H2O + 3SO42- + 6H+
ClO3 - + 6H+ + 3SO32- + 3 H2O → Cl- + 3H2O + 3SO42- + 6H+
KClO3 + 3Na2SO3 → KCl + 3Na2SO4
Рассчитаем массу хлората калия m(KClO3)= ω∙ρ∙V = 0.10∙1.09 ∙ 100 =10.90 г
M(KClO3) = 122,5 г/моль; МЭ = fЭ ∙ М; МЭ = 122,5 ∙ 1/6 = 20,41 г/моль
M(Na2SO3) =126,0 г/моль; МЭ = 126,0 ∙ 1/2 = 63,0 г/моль;
Согласно закону эквивалентов:

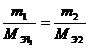 m2 =
m2 = 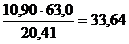 г Na2SO3
г Na2SO3
Контрольные вопросы
1. Напишите уравнение Нернста, поясните физический смысл величин, входящих в это уравнение.
2. Как влияет среда на величину восстановительного потенциала? Приведите два примера полуреакций, протекающих с участием катионов водорода и напишите для них выражение уравнения Нернста.
3. Как влияет среда на величину восстановительного потенциала? Приведите два примера полуреакций, протекающих с участием гидроксид-ионов и напишите для них выражение уравнения Нернста.
4. Назовите основные окислители, которые применяются в качественном анализе для обнаружения ионов. Приведите примеры таких реакций.
5. Назовите восстановители, которые применяются в качественном анализе для обнаружения ионов. Приведите примеры таких реакций.
6. Какими способами можно увеличить или уменьшить значение потенциала редокс-пары? Подтвердите ответ расчетами.
Задания для самостоятельной работы студентов.
1. Методом ионно-электронного баланса уравняйте следующие реакции, определите окислитель и восстановитель:
1. CrCl3 + KOH + H2O2 → K2CrO4 + KCl + H2O
2. AsH3 + KMnO4 + H2SO4 → H3AsO4 + MnSO4 + K2SO4 + H2O
3. Mn(NO3)2 + HNO3 + ↓PbO2 → Pb(NO3)2 + HMnO4 + H2O
4. Na2[Sn(OH)4] + NaOH + Bi(NO3)3 → Na2[Sn(OH)6 ] + NaNO3 + ↓Bi
5. I2 + HNO3 → HIO3 + NO + H2O
6. Mn(NO3)2 + HNO3 + K2S2O8 + H2O → HMnO4 + H2SO4 + KNO3
7. K2Cr2O7 + Na2SO3 + H2SO4 → Cr2(SO4)3 + Na2SO4 + K2SO4 + H2O
8. Na2HAsO4 + Zn + HCl → HAsO2 + ZnCl2 + NaCl + H2O
9. H3PO3 + KMnO4 + HNO3 → H3PO4 + KNO3 +Mn(NO3)2 + H2O
10. K2Cr2O7 + KI + HCl → I2 + KСl +CrCl3 + H2O
11. I2 + Na2S2O3 → NaI + Na2S4O6
12. As2O3 + Zn + HCl → AsH3 + ZnCl2 + H2O
2. В каком направлении будет протекать реакция между редокс - парами: Pb2+/Pb и Sn2+/Sn. Изменится ли направление реакции, если концентрацию ионов свинца(II) уменьшить в 10 раз?
3. При добавлении к раствору сульфата меди (II) раствора йодида калия выпадает осадок малорастворимого йодида меди (I) Изменится ли направление реакции в результате образования осадка? (ПРCuI= 10-12). Ответ подтвердите расчетами.
4. Можно ли хлоридом железа (II) в кислой среде восстановить перхлорат калия до свободного хлора? Ответ подтвердите расчетами.
5. Можно ли хлоридом железа (III) окислить в растворе ионы:
а) Cr2+ ; б) Co2+? Ответ подтвердите расчетами.
6. Определите в какую сторону должен идти окислительно-восстановительный процесс в стандартном кислом растворе, содержащем:
a) KMnO4, MnSO4, HI, I2;
b) FeCl2, FeCl3, CeCl2, CeCl4;
c) KMnO4, MnSO4, H2SO3, H2SO4
7. Раствор какого вещества является более сильным окислителем HClO или NaClO?
8. Можно ли окислить хром (III) в дихромат- ион хлорной водой в кислой среде? Напишите уравнение реакции, выполните расчеты.
9. Какие свойства (окислительные или восстановительные) проявляет в кислой среде Н2О2 при взаимодействии с дихроматом калия? Напишите уравнение реакции.
10. Бромная вода является реактивом, который используется в качественном анализе как окислитель. Какие из перечисленных ионов можно окислить бромной водой: а) олово (II); кобальт(II); хром(II).
11. Вычислите восстановительный потенциал полуреакции:
NO3- + 10 H+ + 8 e → NH4+ + 3 H2O,
если [NO3-] = 2 моль/л, [NH4+] = 0,5 моль/л, рН= 2
13. Рассчитайте восстановительный потенциал полуреакции:
HNO2 + 7H+ + 6e → NH4+ + 2H2O,
если [HNO2-] = 0.8 моль/л, [NH4+] = 0,4 моль/л, рН= 3
14. Рассчитайте восстановительный потенциал полуреакции:
MnO4- + 2H2O +3e → MnO2 + 4OH-
если [MnO4-]= 0,1 моль/л, рН = 7
15. Рассчитайте величину восстановительного потенциала редох - пары BrO3-/Br- при рН=6 в растворе, в котором молярные концентрации бромат – и бромид-ионов одинаковы.
16. Восстановительный потенциал редокс - пары олово(IV) - олово(II) равен 0,2 В. Чему равно отношение молярных концентраций окисленной и восстановленной форм редокс – пары в растворе?
17. Восстановительный потенциал редокс – пары железо(III) - железо(II) равен 0,712 В. Чему равно отношение молярных концентраций окисленной и восстановленной форм редокс – пары в растворе?
18. Рассчитайте величину восстановительного потенциала редокс - пары железа (III) - железо(II) если отношение молярных концентраций окисленной и восстановленной форм в растворе равно:
а) 1:1; б)10:1; в) 1:10;
19. Можно ли осуществить окисление йодид – и бромид – ионов ионами железа(III) в стандартных условиях? Ответ подтвердите расчетами.
20. Рассчитайте массу сульфита натрия, необходимую для восстановления в кислой среде 200 мл раствора хлората калия с массовой долей 5,0 % и плотностью 1,08 г/мл. Напишите уравнение реакции, учитывая переход хлорат-иона в хлорид-ион.
21. Рассчитайте объем раствора йодата калия с массовой долей 40,0 % и плотностью 1,08 г/мл, которым можно окислить в кислой среде 200 мл йодида калия с молярной концентрацией эквивалента СЭ= 0,500 моль/л.
22. Какая масса висмутата натрия может заменить в реакции 3,34 г бромата калия, если обе соли действуют как окислители в кислой среде.
23. На окисление 6,64 г восстановителя в кислой среде израсходовано 200 мл перманганата калия с молярной концентрацией эквивалента, равной 0,200 моль/л. Рассчитайте молярную массу эквивалента восстановителя.
24. На окисление 3,32г восстановителя в кислой среде израсходовано 100 мл раствора перманганата калия с молярной концентрацией эквивалента, равной 0,500 моль/л. Рассчитайте молярную массу эквивалента восстановителя.
25. Рассчитайте какой объем раствора сульфата железа (II) с массовой долей 21,0% и плотностью 1,22 г/мл необходим для восстановления 29,4 дихромата калия в кислой среде.
26. Какой объем раствора перманганата калия с массовой долей 2,5 % и плотностью 1,00 г/мл необходим для окисления 250 мл раствора нитрита натрия с массовой долей 5,0 % и плотностью 1,03 г/мл (среда кислая).