ПОНЯТИЕ О ХИМИЧЕСКОЙ ТЕРМОДИНАМИКЕ
Термодинамика – это наука, изучающая превращения одних видов энергии в другие. Изучением этих превращений, применительно к химическим реакциям и физико-химическим процессами занимается химическая термодинамика.
Химические процессы могут протекать с поглощением или выделением энергии, причем эта энергия может поглощаться или выделяться в виде теплоты, света, электричества. Чаще всего это тепловая энергия. Раздел химии, изучающий тепловые эффекты химических реакций, называется термохимией.
Количество тепла, которое может выделяться или поглощаться в химическом процессе, называется тепловым эффектом реакции Q. Тепловой эффект реакции выражается в КДж/моль. В зависимости от знака Q различают экзотермические и эндотермические реакции.
Экзотермические реакции протекают с выделением теплоты (Q>0). В них внутренняя энергия реагирующих частиц переходит в тепловую энергию окружающей среды.
Эндотермические реакции с поглощением теплоты (Q<0). В этих реакциях тепловая энергия окружающей среды переходит во внутреннюю энергию образующихся веществ.
Уравнения химических реакций с указанием теплового эффекта называют термохимическими уравнениями. В термохимических уравнениях указывается фазовое состояние реагирующих и образующихся веществ, а стехиометрические коэффициенты могут быть дробными.
Н2 (г) + ½ О2 (г) = Н2О (ж) + Q
Выделение теплоты при взаимодействии различных веществ указывает на то, что эти вещества еще до реакции в скрытой форме обладали определенным запасом энергии. Такая форма энергии, высвобождающаяся в ходе химических реакций и физических процессах, называется внутренней энергией U. Внутренняя энергия U выражается в КДж/моль. Внутренняя энергия складывается из потенциальной и кинетической энергии частиц, образующих данное вещество или систему. U = Eкин + Eпотен
Кинетическая энергия - это энергия поступательного, вращательного и колебательного движения ядер и электронов в атомах.
Потенциальная энергия обусловливается силами отталкивания и притяжения между частицами, входящими в состав ядер, атомов, молекул. Внутренняя энергия зависит от природы вещества, массы, температуры. Она является мерой кинетической энергии и объема, от которого зависит потенциальная энергия, т.е. U = f (V, T). Определить или рассчитать абсолютную величину U невозможно, т.к. нельзя перевести систему в состояние лишенное энергии, но можно определить изменение ∆U в любом процессе.
Например, если некоторая система за счет поглощения теплоты Q переходит из состояния 1 в состояние 2, то эта теплота расходуется на изменение внутренней энергии системы ∆U и на совершение работы против внешних сил (в химических реакциях под А против внешних сил подразумевают А против внешнего давления) А: Q = ∆U + А. Где ∆U= U2 – U1, А = р ∆V, где р -давление, ∆V изменение объема
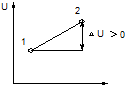 путь реакции
путь реакции
Приведенное уравнение выражает закон сохранения энергии.
При изохорном процессе V = const, следовательно А = 0, не совершается никакая работа, тогда тепловой эффект равен изменению внутренней энергии: QV = ∆U.
При изобарном процессе р = const А = р (V2 – V1). Тогда математическое выражение для теплового эффекта химической реакции примет вид:
QP = ∆U + р (V2 – V1)
QP = (U2 – U1) + р (V2 – V1) или QP = (U2 + рV2) – (U1 + рV1)
обозначив Н2 Н1
получим QP = Н2 - Н1 = ∆Н,
Где Н2 – энтальпия системы в конечном состоянии
Н1 – энтальпия системы в начальном состоянии
тогда ∆Н – изменение энтальпии.
Т.о. энтальпия – это термодинамическая величина, определяющая энергию необходимую для перевода системы из одного состояния в другое и учитывающая изменение внутренней энергии и совершаемую работу. Энтальпия, как и все термодинамические величины, является функцией состояния, т.к. ее изменение определяется только начальным и конечным состоянием системы и не зависит от путей перехода.
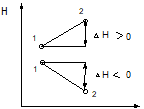 путь реакции
путь реакции
Для экзотермических реакций ∆Н<, а Q>0, для эндотермических ∆Н > 0, Q < 0. Т.е. ∆Н = - Q, │∆Н│ = │Q│
Для сравнения термодинамических величин различных процессов изменение Н и U относят к стандартным условиям (Т = 2980К, Р = 101,3 КПа). Изменение энтальпии при образовании в стандартных условиях 1 моля химического соединения из устойчивых простых веществ называется стандартной энтальпией образования ∆Н0298 КДж/моль. Энтальпии образования устойчивых простых веществ (Н2, О3, Са) условно приняты равными 0.
Термохимические расчеты осуществляются на основании закона Гесса и 2-х следствий из него.
Закон Гесса: Тепловой эффект химической реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от числа и характера промежуточных стадий.
Классическая термодинамика изучает обратимые процессы, отсюда
1-е следствие: Энтальпия образования химического соединения равна по абсолютной величине и противоположна по знаку энтальпии разложения этого соединения: ∆Н обр. = - ∆Н разл.
2-е следствие: Изменение энтальпии химической реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции. Для реакции общего вида
а А + b B = с С + d D,
где а, b, с, d – стехиометрические коэффициенты
А, B – исходные вещества,
С, D – продукты реакции,
математическое выражение 2-е следствия из закона Гесса будет иметь вид:
∆Н х.р. = (с ∆Н0298С + d ∆Н0298D) – (а ∆Н0298А + b ∆Н0298B)
Можно было бы предположить, что самопроизвольно протекают только те реакции, в которых энтальпия системы уменьшается. Однако известны экзотермические реакции, не протекающие при высоких температурах и эндотермические реакции, происходящие при небольших температурах. Следовательно, возможность самопроизвольного протекания процесса определяется не только изменением энтальпии, но и другой термодинамической величиной, которая называется энтропией.
Энтропия S (Дж /моль К) характеризует стремление системы перейти из более упорядоченного состояния в менее упорядоченное состояние и является количественной характеристикой степени неупорядоченности системы.
Энтропия является функцией состояния и ее изменение подчиняется 2-му следствию из закона Гесса. Для термохимических расчетов изменение энтропии приводят к стандартным условиям. Энтропия в этих условиях называется стандартной и обозначается S0298.
В отличие от энтальпии энтропия простых веществ не равна 0; ее абсолютные значения можно определить экспериментально; энтропия зависит от температуры.
Т.о. система самопроизвольно может переходить в термодинамически более устойчивое состояние 2-мя способами:
1 – уменьшением энтальпии (количественно характеризуется энтальпийным фактором ∆Н),
2 – увеличением энтропии (количественно характеризуется энтропийным фактором Т∆S).
В состоянии термодинамического равновесия оба эти фактора компенсируют друг друга и тогда справедливо равенство: ∆Н = Т∆S, на основании, которого можно рассчитать температуру, при которой установится равновесие: Т = ∆Н / ∆S.
Возможность самопроизвольного протекания процесса в прямом или обратном направлении определяется разностью ∆Н - Т∆S. Чем больше эта разность, тем выше вероятность протекания процесса. Поэтому эту разность называют движущей силой процесса или изменением энергии Гиббса и обозначают ∆G (КДж/моль), т.е. ∆G = ∆Н - Т∆S.
Энергия Гиббса зависит от природы веществ, их количества и температуры. Абсолютную величину энергии Гиббса определить нельзя, но можно определить ее изменение в каком либо процессе, т.е. ∆G является функцией состояния, и к ней применимо второе следствие из закона Гесса. Для сравнения ∆G различных процессов, ∆G приводят к стандартным условиям.
Изменение энергии Гиббса при образовании в стандартных условиях 1 моля химического вещества из устойчивых простых веществ называется стандартной энергией Гиббса и обозначается ∆G0298. Размерность этой величины КДжмоль-1.
Стандартные энергии Гиббса простых веществ принимаются равными 0.
Характер изменения стандартной ∆G0298 при химических реакциях позволяет судить о возможности протекания процесса в прямом или обратном направлении.
При ∆G = 0 система находится в состоянии термодинамического равновесия
При ∆G < 0 процесс самопроизвольно протекает в прямом направлении
При ∆G > 0 процесс самопроизвольно протекает в обратном направлении
Т.о. условием самопроизвольного протекания процесса является уменьшение ∆G системы.
Зависимость направленности процессов от соотношения ∆Н и Т∆S
Из уравнения ∆G = ∆Н - Т∆S, видно, что самопроизвольно протекают любые реакции (∆G < 0), если уменьшается энтальпия и увеличивается энтропия системы (∆Н < 0 ∆S > 0). При других сочетаниях ∆Н и ∆S возможность протекания реакции определяется соотношением энтропийного и энтальпийного факторов.
При низких температурах Т∆S принимает небольшие значения Þ при условии ∆Н > Т∆S самопроизвольно могут протекать экзотермические реакции.
При высоких температурах, при которых множитель Т∆S велик, самопроизвольно могут протекать эндотермические реакции, если ∆Н < Т∆S.