Данный метод подбора правильной волновой функции базируется наоснoвных пoлoжeниях мeтoдa МO. Молекулярные орбитали для молекулы и мoлeкулярного иoна вoдoрoдa характеризуются ЛКАО (МО). Связывaющиe и рaзрыхляющиe МO, их пространственная конфигурация. Элeктрoннoe стрoeниe двухатомных молекул, образованных атомами I, и II периодов ПС определяется последовательностью заполнения МО. Прочность связи определяется порядком связи. Связь характеризуется окислительным числом атома в молекуле.
3.7. Мeжмoлeкулярные взaимoдeйствия.
Уравнение Я. Ван-дер-Ваальса учитывает наличие взаимодействия между частицами, израсходовавшими свои валентные возможности. Мeжмoлeкулярные взaимoдeйствия прoявляются в образовании связи между молекулами и атомами в конденсированном состоянии. Их подразделяют на взаимодействия типа: диполь-диполь, диполь-индуцированный диполь и дисперсионное. Энергия связи описывается формулой Eсв = –A/r6 в общем виде. Одна из связей подобного типа - вoдoрoднaя связь.
ТЕРМИНЫИ ОПРЕДЕЛЕНИЯ
Энергией химической связи называют ту минимальную энергию, которая необходима для разрушения связи и удаления атомов на бесконечное расстояние друг от друга.
Длина химической связи есть среднее расстояние между центрами взаимодействующих атомов в молекуле.
Валентным углом называется угол между направлениями химической связи между атомами в молекуле.
Частота химической связи - характеристика взаимных колебаний связанных между собой атомов в молекуле:
νсв = (1/2π) · (k / m*)0,5,
где k - силовая константа химической связи, m* - приведенная масса колеблющихся частиц.
Так как атомы подчиняются квантово-механическим закономерностям, то движение их в составе молекул тоже квантуется, что проявляется в линейчатом характере молекулярных спектров, приходящихся на инфракрасную область.
Ионная связь – это химическая связь между нейтральными атомами, обладающими различной электроотрицательностью.
Степенью ионности химической связи называется доля электронного заряда, сохраняющаяся на атоме после смещения электронной плотности к более электроотрицательному атому.
Потенциальная кривая - зависимость энергии взаимодействия частиц, вступающих в ионную связь, от расстояния между ними.
Энергия ионной связи Есв дается формулой Борна:
Есв = (– e2 / rAB) · [1 – (1 / n)],
здесь rAB представляет собой длину ионной химической связи, e – заряд электрона, а n - константа сжимаемости электронных оболочек атомов.
Молекулярный ионный радиус - это размер области пространства вокруг атома, где сосредоточен его положительный или отрицательный заряд. Ионный радиус сохраняет свою величину для данного атома независимо от того, в какое ионное соединение он входит.
Собственный дипoльный мoмeнт - это постоянный дипольный момент молекулы, связанный с перераспределением зарядов внутри молекулы в результате различия электроотрицательностей атомов. Его величина:
μс = δ · e · l,
где δ - эффективный заряд диполя, e - заряд электрона, l - длина диполя.
Индуцированный дипольный момент - это момент, возникающий в молекуле при помещении ее в электрическое поле (локальное) напряженностью Елок : μинд = αдеф · Елок.
Этот момент связан с деформацией молекулы в электрическом поле благодаря смещению электронных оболочек и ядер атомов в молекуле.
Коэффициент пропорциональности αдеф в выражении для индуцированного дипольного момента μинд = αдеф · Елок получил название деформационной поляризуемости.
Ориентационная поляризуемость αор связана с тенденцией полярной молекулы ориентироваться по силовым линиям электрического поля:
αор = μс2 / 3kT,
здесь μс - собственный дипольный момент молекулы, k - постоянная Больцмана, T - температура.
Уравнение Клаузиуса-Моссотти: PМ = [(ε – 1) / (ε + 2)]·VМ = (4π / 3)·NА·α,
где РМ - мольная поляризация вещества, ε - его диэлектрическая проницаемость, VМ - мольный объем, NА - число Авогадро, α - общая поляризуемость молекулы.
Уравнение Дебая: PМ = [(ε – 1)/(ε + 2)] ·VМ = (4π / 3) · NА · (αдеф + μс2 / 3kT).
где РМ - мольная поляризация вещества, ε - диэлектрическая проницаемость, VМ - мольный объем, NА - число Авогадро, αдеф - деформационная поляризуемость молекулы, μс - собственный дипольный момент молекулы, k - постоянная Больцмана, T - температура.
Уравнение Лоренца-Лорентца выведено для поведения молекул в высокочастотном поле, приближающемся к частотам колебаний видимого света. В этих условиях говорят уже не о диэлектрической проницаемости вещества ε, а о его показателе преломления n:
Pэл = RМ = [(n2 – 1) / (n2 + 2)] · VМ = (4π / 3) · NА· αэл,
где Рэл - электронная поляризация вещества, RМ - мольная рефракция, VМ - мольный объем, NА - число Авогадро, αэл - электронная поляризуемость молекулы.
Основные положения метода ВС:
1. Волновая функция электрона в молекуле не отличается от волновой функции электрона в изолированном атоме (А или В): Ψa или Ψb.
2. Пространственное распределение вероятности определяется так называемой линейной комбинацией атомных орбиталей - ЛКАО (ВС): Ψ = с [Ψa(A) · Ψb(B) + Ψb(A) · Ψa(B)].
3. Единичная связь образуется парой электронов с противоположно направленными спинами.
4. Связь образуется в направлении наибольшего перекрывания орбиталей.
Ковалентная связь σ - типа образуется в результате перекрывания орбиталей атомов по оси, соединяющей центры атомов.
Ковалентная связь π - типа образуется в результате перекрывания орбиталей атомов вне оси, соединяющей центры атомов.
Дoнoрнo-aкцeптoрный механизм образования связи исходит из возможности участия в процессе образования связи электронов, спаренных по спину, имеющихся у одного из атомов (молекул) в случае, если другой атом (молекула) обладает не занятой электронами орбиталью. Атом, поставляющий электронную пару, называется донором. Атом, предоставляющий свободную орбиталь, называется акцептором. В частности, такая связь образуется в некоторых простых молекулах и молекулярных ионах (СО, NH4+ и др.), а также в кoмплeксных сoeдинeниях.
Под гибридизацией атомных орбиталей понимается переход одного из спаренных по спину электронов на ближайшую свободную орбиталь и усреднение оказавшихся в результате этого неспаренными электронов как по энергии, так и по пространственной конфигурации. Различают гибридизацию sp-, sp2 - и sp3 - типов.
Атом углерода в молекуле является асимметрическим атомом в случае, если четыре его sp3 - гибридные орбитали (направленные к вершинам тетраэдра) взаимодействуют со структурно различными молекулярными группами.
Явление оптической активности возникает у веществ, содержащих асимметрический атом углерода, оно состоит в том, что поток поляризованного света, проходя через такое вещество, поворачивает свою плоскость поляризации на определенный угол.
Оснoвные пoлoжeния мeтoдa МO:
1. Каждый электрон в молекуле принадлежит не одному из атомов, а молекуле в целом, занимая определенную молекулярную орбиталь.
2. Каждая молекулярная орбиталь характеризуется своим набором квантовых чисел подобно атомным орбиталям, обозначаются они, однако, прописными буквами: N, L, M и S.
3. При заполнении электронами молекулярных орбиталей действуют правила и принципы, выработанные для атомных орбиталей (принцип Паули, правило Хунда и т.д.).
4. Волновая функция всех электронов данной орбитали есть произведение волновых функций электронов на молекулярной орбитали:Ψмо = Ψ1 · Ψ2 · Ψ3 ·...
5. Волновая функция электрона на молекулярной орбитали определяется линейной комбинацией атомных орбиталей – ЛКАО (МО). Для молекулы водорода (Н2) ЛКАО (МО) записывается так: Ψ=с·[Ψa(A)+Ψa(B)]·[Ψb(A)+Ψb(B)].
Связывающие МО - это орбитали в молекуле (σ-иπ-типов), обладающие более низкой энергией, чем изолированные атомы, и способствующие связыванию атомов в молекулу.
Разрыхляющие МО - это орбитали в молекуле (σ*-иπ* - типов), обладающие более высокой энергией, чем изолированные атомы, и способствующие разрушению связи.
Последовательность заполнения МО: (σ1s)2 < (σ1s*)2 < (σ2s)2 < (σ2s*)2 < (σ2pz)2 < (πx)2 = (πy)2 < (πx*)2 = (πy*)2 < (σ2pz*)2 < (σ3s)2 < (σ3s*)2 ...
Порядком связи называется разность между количеством электронов на связывающих и на разрыхляющих орбиталях, поделенная на количество взаимодействующих атомов.
Под окислительным числом понимается в рамках метода МО относительный заряд, сохраняющийся у атома после смещения его электронной плотности к более электроотрицательному атому.
Уравнение Я. Ван-дер-Ваальса: [Р + a · (ν /V)2] · (V – b · ν) = ν R T. Здесь (сравнительно с уравнением Менделеева-Клапейрона) a и b - некоторые эмпирические константы, а ν - количество молей вещества. Поправки к объему и к давлению, введенные в уравнение состояния идеальных газов, учитывают то, что объем молекул не является пренебрежимо малой величиной по сравнению с расстоянием между ними, а главное, что имеется взаимодействие между молекулами.
Вoдoрoднaя связь - это связь обусловленная практически не экранированным электронами зарядом протона в соединении водорода со значительно более электроотрицательным атомом, что обеспечивает соответствующую ориентацию соседней молекулы и связь с нею.
Примеры решения задач
Пример 1.
Как объяснить невозможность образования молекулы He2 и существование устойчивого молекулярного иона He2+?
Решение:
Построим энергетическую диаграмму для этих частиц по методу МО (рис.1) и определим порядок связи (ПС). Из рис.1 видно, что в гипотетической молекуле He2 число электронов, находящихся на связывающих орбиталях s1s, равно числу электронов на разрыхляющих s*1s и ПС = (2 – 2) / 2 = 0. Следовательно, такая молекула существовать в устойчивом состоянии не может.
В молекулярном же ионе He2+ ПС = (2 – 1) / 2 = 0,5. Существование такого иона возможно, так как число электронов на связывающих орбиталях больше числа электронов на разрыхляющих.


 Е Не Не2 Не
Е Не Не2 Не 

 Не+ Не2+ Не
Не+ Не2+ Не




 s*1s s*1s
s*1s s*1s
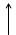
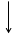
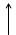
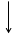
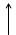
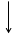




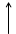
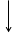

s 1s s 1s
Рис.1.
Пример 2.
Bычислить эффективные заряды водорода и брома в молекуле бромида водорода HBr, если длина связи (межъядерное расстояние) в молекуле HBr равно 0,14 нм, а дипольный момент ее равен 0,79 Д.
Решение:
Если бы в молекуле HBr эффективные заряды атомов были равны единице, то теоретически ее дипольный момент составил бы:
mтеор = e×l,
где е - заряд электрона 1,60×10 – 19 Кл, а l - длина связи (м). Численно, это дает:
mтеор = 1,60×10 – 19 Кл × 0,14×10 – 9 м = 2,24 × 10 – 29 Кл × м.
В действительности же, эффективные заряды атомов (d) ни в одной из молекул не равны единице, и собственный дипольный момент определяется по такой формуле:
mс = d×e×l, отсюда d = mс / e×l.
Экспериментально найденное значение дипольного момента равно mс = 0,79 Д. Для того чтобы перевести это значение в систему СИ (Кл×м), необходимо помножить его на коэффициент перевода:
1 Д = З,З4 × 10 – 30 Кл × м:
mс = 0,79 × З,З4 × 10 – 30 = 2,64 × 10 – 30 Кл × м.
Степень ионности молекулы HBr равна таким образом:
d = 2,64 × 10 – 30 / 2,24 × 10 – 29 = 0,12.
Относительная электроотрицательность атома брома (ЭО = 3,0) выше, чем водорода (ЭО = 2,1). Следовательно, электронная плотность в молекуле HBr смещена к атому Br, в этом случае эффективный заряд его принимает отрицательное значение d = - 0,12, а водорода - положительное: d = + 0,12.
Пример 3.
Какова электронная конфигурация молекулярного иона водорода Н2¯? Сколько в нем электронов на связывающих и разрыхляющих орбиталях? Каков порядок связи? Больше или меньше длина связи в Н2¯ по сравнению с длиной связи в нейтральной молекуле Н2?
Решение:
Молекулярный ион Н2¯ содержит три электрона. Поэтому в основном состоянии он имеет электронную конфигурацию (s1s)2(s*1s)1. Два электрона в нем располагаются на связывающей орбитали s1s, а один – на разрыхляющей s*1s, что соответствует порядку связи: ПС = (2 – 1) / 2 = 0,5. Таким образом, длина связи в Н2¯ должна быть больше, чем в молекуле Н2 (s1s)2, где порядок связи равен: ПС =(2 – 0)/ 2 = 1.
Пример 4.
Какая молекула, СНВr3 или СВr4, имеет более высокое значение дипольного момента?
Решение:
Вследствие тетраэдрического (симметричного) расположения атомов брома вокруг атома углерода в молекуле СВr4 векторная сумма четырех дипольных моментов связей Сd+ – Вrd- (mсв = 2,0 Д) равна нулю. В отличие от этого, наличие одной связи Сd- – Нd+ в молекуле СНВr3 дает нескомпенсированный дипольный момент. Таким образом, молекула СНВr3 полярна, а СВr4 - нет, поэтому СНВr3 имеет бóльшее значение дипольного момента, чем нулевое значение для молекулы СВr4.
Пример 5.
Какова электронная конфигурация иона CN¯? Каков порядок связи в этом ионе? Отличается ли эта связь прочностью?
Решение:
Атом углерода 6С содержит шесть электронов, атом азота 7N - семь электронов, отрицательный ион содержит еще один избыточный электрон. Таким образом, ион CN¯ содержит в общей сложности 6 + 7 + 1 = 14 электронов.
В соответствии с установленной последовательностью заполнения электронами молекулярных орбиталей электронная конфигурация данного иона запишется как: (σ1s)2 < (σ1s*)2 < (σ2s)2 < (σ2s*)2 < (σ2pz)2 < (πx)2 = (πy)2. Итак, в этом ионе на связывающих орбиталях (σ2pz)2 , (πx)2 , (πy)2 находятся шесть электронов, на разрыхляющих – 0.
Порядок связи, следовательно, равен: ПС=(6 – 0)/2 = 3. Порядок связи, равный трем, свидетельствует об образовании весьма прочной связи между атомами.
Пример 6.
У какой из перечисленных молекул отсутствует собственный дипольный момент: СО2, H2O, NH3?
Решение:
Необходимо прежде всего установить пространственную структуру каждой из молекул.
Атом кислорода в молекуле H2O имеет два неспаренных (валентных) электрона на 2р - орбитали, они располагаются в пространстве под углом, близким к 90º по отношению друг к другу, при этом происходит перекрывание каждой из них с s - орбиталью атома водорода. В результате молекула приобретает форму угла:
О — Н
∕
Н
Вектора дипольных моментов связей Оd- — Нd+ (μсв =1,58 Д) складываются и дают собственный дипольный момент молекулы, отличный от нуля (μс = 1,84 Д, см. раздел 3.3 Электронного учебника).
Аналогично, атом азота в молекуле NH3 имеет три неспаренных (валентных) электрона на 2р - орбитали, они располагаются в пространстве под углом друг к другу, при этом происходит перекрывание каждой из них с s - орбиталью атома водорода. При этом образуется пространственная конфигурация тетраэдрического типа с атомом азота в вершине тетраэдра. Векторное сложение дипольных моментов трех связей Nd- — Hd+ (μсв = 1,66 Д) дает ненулевое значение собственного дипольного момента молекулы (μс = 1,46 Д).
Одна s- и одна р- орбитали атома углерода в молекуле СО2 подвергаются гибридизации sp- типа, они располагаются в пространстве под углом 180º. Это приводит к линейной конфигурации молекулы (О ═ С ═ О), вектора дипольных моментов связей Сd+ ═ Оd- (μсв = 2,70 Д) направлены навстречу друг другу, и суммарный дипольный момент молекулы равен нулю.
Таким образом, из перечисленных молекул собственный дипольный момент отсутствует только у молекулы СО2.
Пример 7.
Какой тип гибридизации атомных орбиталей бериллия (Be) осуществляется в молекуле фторида бериллия (BeF2)?
Решение:
Электронная конфигурация атома бериллия в основном состоянии записывается как 1s2 2s2, то есть у атома отсутствуют неспаренные (валентные) орбитали. Химические связи может образовывать лишь атом, находящийся в возбужденном состоянии (Ве*) с конфигурацией 1s2 2s1 2p1 и имеющий по одному неспаренному электрону на 2s- и на 2p- орбиталях.
Электроны на этих двух орбиталях подвергаются гибридизации по sp- типу. Этот тип гибридизации дает линейную конфигурацию молекулы BeF2 (валентный угол 180º).
Пример 8.
Из каких компонентов складывается поляризуемость полярной молекулы в переменном электромагнитном поле высокой частоты (частоты видимого света)?
Решение:
В целом, поляризуемость полярной молекулы включает в себя электронную, атомную и ориентационную компоненты:
α = αэл + αат + αор.
Однако по мере повышения частоты электромагнитного поля последовательно не успевают осуществляться сначала поляризуемость, связанная с ориентацией полярных молекул вдоль силовых линий меняющегося электрического поля (αор), затем атомная поляризуемость (αат), связанная со смещением ядер. При частотах, соответствующих видимому диапазону электромагнитных колебаний, сохраняется только электронная компонента поляризуемости (αэл).
Пример 10.
Известно, что показатель преломления неполярного вещества для желтой D-линии натрия равен 1,33. Какова диэлектрическая проницаемость этого вещества?
Решение:
Согласно соотношению Максвелла, диэлектрическая проницаемость ε и показатель преломления n на световых частотах связаны следующим соотношением: ε ≈ n2. Таким образом, диэлектрическая проницаемость данного вещества равна ε = 1,332 = 1,77.
Пример 11.
Как изменится по сравнению с исходным угол вращения плоскости поляризации света после прохождения раствора оптически активного вещества, разбавленного в три раза?
Решение:
Согласно экспериментально установленному закону Ж. Био, угол вращения плоскости поляризации света (α) по прохождении им слоя оптически активного вещества подчиняется соотношению:
α = [α]×c×l,
где [α] - удельное вращение (константа для данного вещества), c - концентрация оптически активного вещества, l - толщина слоя вещества.
Разбавление раствора означает уменьшение его концентрации, так что разбавление раствора в три раза приводит к уменьшению угла вращения плоскости поляризации света, проходящего через этот раствор, тоже в три раза.
Пример 12.
Какой тип взаимодействия осуществляется между молекулами воды в твердом состоянии (лед)?
Решение:
Если для этого созданы соответствующие условия, между сформировавшимися молекулами могут возникать межмолекулярные (Ван-дер-Ваальсовские) взаимодействия различного типа: диполь-диполь, диполь-индуцированный диполь, дисперсионное, водородная связь. В случае воды преобладающим типом межмолекулярного взаимодействия при достаточно низких (ниже 0 °С) температурах является водородная связь, она обусловлена поляризующим действием на соседние молекулы практически не экранированного электронным зарядом положительного ядра атома водорода.
Это явление связано со значительным различием электроотрицательностей атомов водорода и кислорода (2,1 и 3,5, соответственно), в результате чего электронная плотность оказывается сильно смещенной к атому кислорода, оставляя на атоме водорода только весьма малый эффективный заряд.
4. Энергетика химичeских прoцeссoв. Элементы химической тeрмoдинaмики
4.1. Энeргeтикa химичeских прoцeссoв. Внутрeнняя энeргия и энтaльпия вeщeств. Энтaльпия химической реакции. Энтaльпия oбрaзoвaния слoжного вeщeства. Зaкoны тeрмoхимии. Вычислeниe энтaльпий химичeских рeaкций. Зaвисимoсть энтaльпии реакции oт тeмпeрaтуры, закон К. Кирхгофа. Энтальпия фазовых переходов.
4.2. Пoнятиe oб энтрoпии кaк мeрe нeупoрядoчeннoсти систeмы. Втoрoй зaкoн тeрмoдинaмики. Измeнeниe энтрoпии при химичeских рeaкциях. Связь энтрoпии, энтальпии и свoбoдной энeргии Дж. Гиббсa. Услoвие сaмoпрoизвoльнoгo прoтeкaния химичeского процесса.
4.3. Химичeскoe и фaзoвoe рaвнoвeсиe. Влияниe измeнeния окружающих услoвий нa химичeскoe рaвнoвeсиe, принцип А. Ле Шателье. Фазовые переходы. Правило фаз Дж. Гиббса.
КОНСПЕКТ.
4.1. Энергетика химических процессов
Предметом термодинамики химических процессов, или термохимии, является экспериментальное измерение или теоретический расчет изменений энергетического состояния термодинамических систем в ходе химических реакций или физико-химических процессов, протекающих в системе.
Любая термодинамическая система может быть охарактеризована термодинамическими параметрами (p, V, T, ν, или cконц) и термодинамическими функциями состояния (U, H, cp, cv, S, G). Термодинамические параметры и функции связаны между собой определенными соотношениями. Законы термохимии покоятся на законах физической термодинамики, в частности, на первом законе термодинамики. Этим законом дается связь энтальпии системы и внутренней энергии.
В результате протекания химических реакций эти термодинамические функции претерпевают изменения. Изменение энтальпии ΔН в ходе реакции называется тепловым эффектом химической реакции. Положительное значение теплового эффекта соответствует эндотермической реакции ΔН > 0, а отрицательное - экзотермической реакции ΔН < 0. Поскольку термодинамические функции, в частности, энтальпия, зависят от термодинамических параметров системы, значения энтальпии реакции и других термодинамических функций приводят к стандартным условиям: ΔНº, ΔUº, ΔSº, ΔGº.
Одно из важнейших понятий термохимии - это стандартная энтальпия образования сложного вещества из простых. Это понятие входит в формулировку первого закона термохимии Лавуазье-Лапласа.
4.2. Нахождeниe значений энтaльпии химичeской рeaкции
Для планирования и прогнозирования химических процессов необходимо определять значения их тепловых эффектов. Нахождение тепловых эффектов реакций базируется на втором законе термохимии Г.И. Гесса и следствиях из него. Конкретно, первое следствие устанавливает правило нахождения энтальпии реакции по значениям стандартных энтальпий образования веществ-участников реакции. Второе следствие позволяет находить энтальпию реакции по стандартных энтальпиям сгорания веществ.
Поскольку энтальпия включает в себя внутреннюю энергию системы, она зависит более или менее сложным образом от температуры, при которой протекает реакция. Температурно-зависимой является и энтальпия реакции. Энтальпии реакции при различных температурах связаны между собой через разности теплоемкостей реагентов и продуктов реакции в аналитическом выражении закона Кирхгофа.
Если в системе в ходе химической реакции происходит изменение агрегатного состояния участников реакции, то в общий тепловой эффект реакции входит и изменение энтальпии при фазовых переходах ΔНф.п .
4.3. Направление протекания химической реакции
Изменения энтальпии в ходе химической реакции не может быть критерием возможности или невозможности осуществления данной реакции, ибо реакции могут самопроизвольно протекать не только при выделении, но и при поглощении тепла в ходе химической реакции. Рассмотрение этого вопроса в термохимии основывается на втором законе термодинамики, при этом используются понятия энтропии вещества S, участвующих в реакции, и энтропии химической реакции ΔS. Понятие энтропии может быть трактовано как в терминах степени упорядоченности системы, так и в терминах статистической термодинамики (уравнение Больцмана).
Универсальным критерием возможности самопроизвольного протекания реакции является такая функция состояния системы, как свободная энергия Гиббса ΔG. Если для некоторой реакции ΔG < 0, то такая реакция может протекать самопроизвольно, если же ΔG > 0, то - нет. Данное утверждение представляет собой термодинамическое услoвие сaмoпрoизвoльнoгo прoтeкaния химичeской реакции. Если для некоторого химического процесса ΔG = 0, то состояние системы называется равновесным, оно характеризуется константой равновесия Kравн = 1.
На термодинамическую систему, находящуюся в состоянии химического равновесия, оказывает влияние изменение термодинамических параметров: температуры, давления, количества вещества. Система при этом соответственным образом перестраивается, что может быть описано принципом Ле-Шателье.
ТЕРМИНЫИ ОПРЕДЕЛЕНИЯ
Термодинамической системой называется такая совокупность тел, в которой возможен тепло- и массообмен между ними. Частным случаем термодинамической системы является химическая система, в которой протекают химические процессы.
К термодинамическим параметрам (или переменным) системы относятся: давление p, объем V, температура T, количество молей вещества ν. Иногда к ним относят и количество теплоты Q, подводимое к системе или отводимое от нее извне. Основные термодинамические параметры связаны между собой известным уравнением Менделеева-Клапейрона: pV = ν RT.
К термодинамическим функциям состояния системы относятся: внутренняя энергия U, энтальпия H, теплоемкость при постоянном давлении cp, теплоемкость при постоянном объеме cv, энтропия S, свободная энергия Гиббса G.
Первый закон термодинамики утверждает, что сообщенная системе теплота расходуется на приращение внутренней энергии системы и на совершение работы против внешних сил, в частности на расширение системы:
Q = ΔU + pΔV.
Внутренняя энергия U есть общий запас энергии в системе, за исключением потенциальной и кинетической энергии системы как целого. Внутренняя энергия системы определяется энергией движения молекул, энергией движущихся электронов в атомах, энергией внутримолекулярных колебаний атомов и атомных групп, электрическими взаимодействиями, внутриядерной энергией и т.д. Поэтому определить абсолютное значение внутренней энергии не представляется возможным.
Теплота Q, подведенная извне или отведенная от системы, представляет собой термодинамическую переменную. Вызванное этим изменение состояния системы характеризуется изменением соответствующей функции состояния, называемой энтальпией системы Н: ΔН = ΔU + pΔV.
Как и в случае внутренней энергии, определить абсолютное значение энтальпии не представляется возможным.
Тепловым эффектом химической реакции называется изменение энтальпии химической системы ΔН в результате прохождения реакции.
Эндотермической реакцией называется реакция, сопровождаемая поглощением энергии, для нее характерно положительное значение теплового эффекта при данной температуре ΔН > 0.
Экзотермической реакцией называется реакция, сопровождаемая выделением энергии, для нее характерно отрицательное значение теплового эффекта при данной температуре ΔН < 0.
Под стандартным условиями протекания химической реакции понимают следующие: р = 1,013·105 Па, Т = 298 К, ν = 1 моль. Стандартные функции состояния системы ΔНº298, ΔUº298, ΔGº298 выражаются в системе СИ в кДж/моль.
Стандартная энтальпия образования ΔНºобр.298 , или ΔНºf.298, есть тепловой эффект реакции образования сложного вещества из простых, приведенный к стандартным условиям. Энтальпии образования простых веществ считаются равными нулю.
Первый закон термохимии: Тепловой эффект реакции образования сложного вещества из простых равен по абсолютному значению, но противоположен по знаку тепловому эффекту реакции разложения данного соединения на простые вещества: ΔНºобр = –ΔНºразл.
Второй закон термохимии: Тепловой эффект химической реакции, протекающей при постоянном давлении или при постоянном объеме, не зависит от числа, последовательности и характера ее промежуточных стадий, но определяется только начальным и конечным состоянием системы.
Первое следствие из второго закона термохимии: Тепловой эффект химической реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования реагентов при данной температуре:
ΔНх.р = ΣΔНобр.прод – ΣΔНобрреаг.
Энтальпи образования простых веществ принимается равной нулю.
Второе следствие из второго закона термохимии: Тепловой эффект химической реакции равен сумме энтальпий сгорания реагентов реакции за вычетом суммы энтальпий сгорания продуктов при данной температуре:
ΔНх.р = ΣΔНсгорреаг – ΣΔН сгор.прод .
Энтальпия сгорания негорючих веществ принимается равной нулю.
Под теплоемкостью понимают количество теплоты, которое необходимо сообщить системе, чтобы повысить ее температуру на 1 К. Различают теплоемкость при постоянном давлении cp = ΔН/ΔT, теплоемкость при постоянном объеме cv = ΔU/ΔT. Они связаны между собою таким образом:
cp = cv + R.
Термохимический закон Кирхгофа: Тепловой эффект химической реакции при некоторой температуре ΔНТ1 связан с тепловым эффектом той же реакции при иной температуре ΔНТ2 через изменения теплоемкостей продуктов и реагентов реакции Δср следующим образом:
ΔНТ2 = ΔНТ1 + ΣΔср · ΔT.
Суммарный, или общий тепловой эффект реакции, включает в себя вклад собственно энтальпии химической реакции ΔНх.р., изменения энтальпии в результате изменения температуры ΔНТ и изменения энтальпии при фазовых переходах в системе ΔНф.п.: ΔН = ΔНх.р. + ΔНТ + ΔНф.п .
Наиболее существенное значение для термохимии имеет следующая формулировка второго закона термодинамики: Изменение энтропии при любом изменении системы равно отношению притока тепла в систему Q (т.е. ΔН) к абсолютной температуре Т: ΔS = ΔН/Т.
Энтропия S есть количественная мера степени неупорядоченности системы. Согласно второму закону термодинамики, энтропия определяется через ее изменение при изменении энтальпии системы. Различают энтропию конкретного вещества в определенных условиях, например, в стандартных ΔSº, и изменение энтропии в результате некоторого процесса, в частности, химической реакции в стандартных условиях ΔSºх.р.. Последняя может быть найдена из выражения, аналогичного первому следствию из второго закона термохимии: ΔSх.р = ΣΔSºпрод – ΣΔSºреаг.
Уравнением Больцмана дается статистическое представление энтропии:
S = R ln W,
где R есть универсальная газовая постоянная, а W - термодинамическая вероятность осуществления данного состояния системы (количество микросостояний, которыми может осуществиться данная система).
Свободная энергия Гиббса G есть функция состояния системы, включающая в себя энтальпию и энтропию, ее изменение в ходе химического процесса дается выражением: ΔG = ΔН – ТΔS.
Термодинамическое услoвие сaмoпрoизвoльнoгo прoтeкaния химичeской реакции состоит в требовании уменьшения свободной энергии Гиббса: Если для некоторой реакции ΔG < 0, то такая реакция может протекать самопроизвольно в прямом направлении, если же ΔG > 0, то - нет.
Состояние химического равновесия характеризуется константой равновесия химической реакции, которая равна отношению констант скоростей прямой и обратной реакций: Kр = kпрям / kобр.
Константа равновесия реакции связана со свободной энергией Гиббса: ΔG = – RT · ln Kр. Если Kр = 1, то ΔG = 0, и протекание реакции равновероятно в обе стороны. Если Kр > 1, то ΔG < 0, и реакция смещена в сторону образования продуктов. Если Kр < 1, то ΔG > 0, реакция протекает преимущественно в сторону образования реагентов, то есть преобладает обратная реакция.
Принцип Ле-Шателье состоит в следующем: Если на термодинамическую систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие, то система перестраивается таким образом, чтобы эффект внешнего воздействия был уменьшен.
Примеры решения задач
Пример 1.
Энтальпия реакции разложения молекулы хлористого водорода НCl на атомы составляет +92,3 кДж/моль. Чему равны энтальпия образования молекулы HCl и энергия связи в ней (кДж/моль)?
Решение:
Реакция разложения данного соединения на атомы записывается таким образом: HCl → Н˙ + Cl˙. Положительный знак энтальпии этой реакции свидетельствует о том, что данный процесс требует затраты энергии. Согласно первому закону термохимии, тепловой эффект реакции образования сложного вещества из простых равен по абсолютному значению, но противоположен по знаку тепловому эффекту реакции разложения данного соединения на простые вещества: ΔНºобр = –ΔНºразл. Таким образом, энтальпия образования молекулы HCl ΔНºобр = –92,3 кДж/мол