Цель урока: установить связь между изменением внутренней энергии системы, работой и количеством теплоты, переданной системе
Задачи урока: образовательная: рассмотреть первый закон термодинамики, как закон сохранения энергии для тепловых процессов, необратимость тепловых процессов;
развивающая: развивать умения мыслить, всех видов памяти, умение выделять главное, развивать видения логических связей внутри предмета, умение использовать полученные знания на практике, продолжить формирование единой картины мира;
воспитывающая: повышать интерес обучающихся к изучению физики; воспитывать умение слушать товарищей, формировать и защищать свою точку зрения; воспитывать умение рационального использования своего времени.
I. Проверка домашнего задания
1. Формула количество теплоты парообразования
2. Формула количества теплоты при нагревании, охлаждения
3. Удельная теплота плавления, конденсации.
4. Переход из шкалы Цельсия в шкалу Кельвина.
5. Удельная теплота сгорания топлива
6. количество теплоты нагревания, охлаждения.
7. Формула количество теплоты сгорания топлива
8. Удельная теплоемкость вещества
9. Относительная влажность воздуха.
10. Удельная теплота парообразования, конденсации.
11. Формула количество теплоты плавления, кристаллизации.
12. Решить задачу 2 стр.255
II. Изучение нового материала
Первый закон термодинамики - это закон сохранения энергии, который распространяется на тепловые явления. Работа А является мерой изменения механической энергии, количество теплоты Q - мера изменения внутренней энергии, при взаимных преобразованиях внутренней и механической энергий спад одной из них равен приросту другой.
Закон сохранения энергии: Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно, она только переходит из одной формы в другую.
Закон сохранения энергии в отношении тепловых явлений получил название первого закона термодинамики: Изменение внутренней энергии тела равно сумме количества теплоты, переданного телу, и работы внешних сил, что совершается над телом: ΔU=Q+А
Часто используется и другая формулировка I закона термодинамики, в котором полученное телом количество теплоты выражается через изменение внутренней энергии и работу, совершенную телом.
Работа Аг связана с работой А, которая совершена над телом, в соотношении Аг = -А. Тогда I закон термодинамики можно сформулировать так: Количество теплоты, которая передается телу, равна сумме изменения внутренней энергии тела и работы, которую оно выполняет: Q=ΔU+Аг
Принцип сохранения энергии говорит, что энергия не может быть создана или разрушена, но она может переходить из одной формы в другую. Таким образом, в любой изолированной или замкнутой системе сумма всех видов энергии остается неизменной.Джоуль, Майер и Гельмгольц доказали эквивалентность тепла и работы, показав экспериментально, что каждой определенной работе всегда соответствует определенное количество теплоты. Работа французского ученого Карно «Размышления о движущей силе огня и о машинах, способных развивать эту силу» сыграла особую роль в развитии термодинамики.
Применение первого закона термодинамики к изопроцессам.
Изотермический процесс: Т = const, ∆T = 0; ∆U =0, Q =Аг
Изохорный процесс: V= const, ∆V = 0; Аг = 0. Q = ∆U. 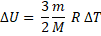
Изобарный процесс: р = const; Аг>0, ∆U>0 Q = ∆U + Аг 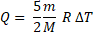
Адиабатный процесс - процесс, протекающий без теплообмена, т.е. Q = 0.Тогда система может совершать работу либо за счет уменьшения внутренней энергии (газ расширяется) Аг= - ∆U, либо за счет работы внешних тел над системой (происходит сжатие газа) А = ∆U.
I закон термодинамики не определяет направление тепловых процессов. Все макроскопические процессы в природе протекают только в одном определенном направлении. В обратном направлении они самопроизвольно протекать не могут. Все процессы в природе необратимы, и самые трагические из них - старение и смерть организмов.
Необратимыми называются такие явления, которые самопроизвольно протекают только в одном направлении; в обратном направлении они протекают только при внешнем воздействии. Нагретые тела постепенно остывают, передавая свою энергию более холодным окружающим телам. Обратный процесс передачи теплоты от холодного тела к горячему не противоречит закону сохранения энергии, если количество теплоты, отданное холодным телом, равно количеству теплоты, полученному горячим, но такой процесс самопроизвольно никогда не происходит.
Ⅲ. Закрепление изученного материала.
1. Сформулируйте первый закон термодинамики, записанный в виде Аг = Q - ∆U.
2. Насколько изменилась внутренняя энергия некоторого газа, который совершил работу 50 кДж, получив количество теплоты 1985 кДж? (Решение: ΔU=Q-А=1985 кДж-50 кДж=1935 кДж, работа отрицательная т.к совершается телом)
3. Для изобарного нагрева 20 моль газа на 200 К ему передали количество теплоты 83 кДж. Какую работу совершил газ? Изменение внутренней энергии?
| Дано: υ=20 моль ΔT=200К Q=83*10³Дж Аг-?ΔU-? | Решение:при изобарному нагревании газ совершил работу Аг=рΔV с учетом уравнения Менделеева-Клапейрона pV = vRT, можно записать: Аг=υR ΔT=20 моль*8,31 Дж/моль*К*200К=33,24*10³Дж Из I закона термодинамики получаем ΔU = Q – Aг=83*10³Дж-33,24*10³Дж=49,76*10³Дж Ответ: Аг=33,24*10³Дж, ΔU=49,76*10³Дж |
Ⅳ.Подведение итогов.
Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно, она только переходит из одной формы в другую.
• Изменение внутренней энергии тела равно сумме количества теплоты, переданного телу, и работы, что совершается над телом: ΔU=Q+А
• Количество теплоты, которая передается телу, равна сумме изменения внутренней энергии тела и работы, которую оно выполняет:Q=ΔU+Аг
V.. Домашнее задание:
§ 78,79 изучить, §80 разобрать решение задач, решить задача 1,2 стр.264