

4. Закон Авогадро
Итальянский физик и химик Амедео Авогадро заложил основы молекулярной теории и привел в единую систему опытные данные Гей-Люссака и в 1811 г. открыл закон:
В одинаковых объемах различных газов при одинаковой температуре и давлении содержится одинаковое число частиц (молекул или атомов).
Следствие: число молекул, которое содержится в 1 моле любого газа, есть величина постоянная: NА= 6,02×1023
Уравнение состояния идеального газа
Состояние газа характеризуется тремя величинами: Р,Т,V. Эти три величины связаны уравнением, которое получило название уравнение идеального газа. Оно выводится путем объединения законов Бойля-Мариотта, Гей-Люссака и Авогадро.
В 1834 г. английский физик Клапейрон и Д.И.Менделеев объединили эти законы и создали общее уравнение: PV = nRT, где
R – универсальная газовая постоянная;
n – количество вещества;
Т– температура.
R = 0,08206 л×атм/(моль×К) или
R = 8,314 Дж/(моль×К) V в м3, Р в Па
Твердое состояние
Существует 2 основные формы твердых веществ: аморфная и кристаллическая.
Главный признак аморфного (от греч. " аморфос " - бесформенный) состояние вещества - отсутствие атомной или молекулярной решетки, то есть трехмерной периодичности структуры, характерной для кристаллического состояния.
Свойства аморфных систем:
1. Структуры аморфных веществ напоминают жидкости, однако обладают гораздо меньшей текучестью.
2. Аморфное состояние обычно неустойчиво, под действием механических нагрузок или при изменении температуры аморфные тела могут закристаллизоваться.
3. Реакционная способность веществ в аморфном состоянии значительно выше, чем в кристаллическом.
4. Аморфные тела изотропны, то есть их механические, оптические, электрические и другие свойства не зависят от направления.
5. Аморфные тела не имеют постоянной температуры плавления (при нагревании они сначала размягчаются в определенном интервале температур, затем, постепенно уменьшая свою вязкость, переходят в жидкотекучее состояние. При охлаждении эти расплавы вновь могут перейти в твердое состояние без образования кристаллической структуры).
Физическая модель аморфного состояния до сих пор не создана.
Многие вещества можно существуют и в кристаллическом и в аморфном состоянии, например кварц SiO2 в природе существует в кристаллическом (горный хрусталь) и аморфном состоянии (опал).
Твердые кристаллические вещества характеризуются:
1) упорядоченным расположением молекул во всем объёме;
2) способностью сохранять определённую форму;
3) снижением скорости движения молекул;
4) снижением межмолекулярного расстояния;
5) возрастанием силы взаимного притяжения молекул (поэтому твёрдое вещество сохраняет форму).
Твердые кристаллы - трехмерные образования, характеризующиеся строгой повторяемостью одного и того же элемента структуры - элементарной ячейки - во всех направлениях.
Элементарная ячейка представляет собой наименьший объем кристаллической решетки вещества, который точно отражает его химический состав и все особенности внутренней структуры данного кристалла.
Геометрически правильная форма кристаллов обусловлена, прежде всего, их строго закономерным внутренним строением. Если вместо атомов, ионов или молекул в кристалле изобразить точки как центры тяжести этих частиц, то получится трехмерное регулярное распределение таких точек, называемое кристаллической решеткой. Сами точки называют узлами кристаллической решетки.
Кристаллические решетки классифицируются в зависимости от типа частиц, образующих кристалл, от природы сил притяжения между ними.
Поэтому различают кристаллические решетки:
- ионные
- ковалентные (атомные)
- молекулярные
- металлические
1) Ионные кристаллические решётки - ионные кристаллы образованы катионами и анионами (например, соли и гидроксиды большинства металлов). В них между частицами имеется ионная связь. Например, решетка, образованная NaCl
 |

Свойства ионных кристаллов:
- ионные кристаллы твердые, но хрупкие. Их хрупкость обусловлена тем, что даже при небольшой деформации кристалла катионы и анионы смещаются таким образом, что силы отталкивания между одноименными ионами начинают преобладать над силами притяжения между катионами и анионами, и кристалл разрушается;
- отличаются высокими температурами плавления;
- электропроводны;
- при растворении в воде диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
2) Ковалентные или атомные - в узлах решётки – атомы, соединенные ковалентными связями. К числу веществ с атомной решеткой относятся кремний, алмаз, графит, бор и т.д. Так же как и ионные, атомные кристаллы можно считать гигантскими молекулами.
Свойства атомных кристаллов:
- прочные и твердые
- плохо проводят теплоту и электричество
- плавятся при высоких температурах
- практически нерастворимы в каких-либо растворителях
- для них характерна низкая реакционная способность
3) Молекулярные (в узлах решетки полярные и неполярные молекулы, связанные ван-дер-ваальсовыми силами). Поскольку силы взаимодействия между молекулами сравнительно слабы, то и вещества с данным типом решетки:
- обладают малой твердостью
- низкими температурами кипения и плавления
- растворы этих веществ, как правило, имеют сравнительно малую электрическую проводимость.
Большинство неметаллов в виде простых веществ (например, йод I2, аргон Ar, сера S8) и соединений друг с другом (например, вода, диоксид углерода, хлороводород), а также практически все твердые органические вещества образуют молекулярные кристаллы.
4) Металлические - решётка образована положительно заряженными ионами, окруженными облаком обобществленных электронов).
Металлические кристаллы обладают:
- высокой электро- и теплопроводностью,
- металлическим блеском
- непрозрачность,
- легкой деформируемостью.
Одно и тоже вещество может существовать в нескольких различных кристаллических формах – модификациях. Явление называется полиморфизмом ( от греч. " полиморфос " – многообразный).
Явление полиморфизма было открыто М. Клапротом, который в 1798 г. обнаружил, что два разных минерала - кальцит и арагонит - имеют одинаковый химический состав СаСО3.
Типичный пример полиморфных форм - модификации углерода (алмаз, графит, карбины и т.д.), которые резко различаются по свойствам.
 | |||
 | |||
Алмаз графит
Полиморфизм простых веществ обычно называют аллотропией, в то же время понятие полиморфизма не относится к некристаллическим аллотропным формам (например, газообразным О2 и О3).
Аллотропия – явление, когда один элемент способен существовать в виде различных простых веществ (О – кислород, озон).
Жидкое состояние
Жидкости по своим свойствам занимают промежуточное положение между твердыми телами и газами.
Сходство с газами:
- текучи
- не имеют определенной формы
- аморфны
- изотропны, т.е. однородны по своим свойствам в любом направлении.
Сходство с твердыми телами:
- жидкости обладают объемной упругостью, они упруго противодействуют не только всестороннему сжатию, но и растяжению;
- молекулы стремятся к некоторому упорядоченному расположению в пространстве, т.е. жидкости имеют зачатки кристаллического строения.
Вязкость
Когда какое-нибудь вещество движется по поверхности, то этому движению препятствует трение. Если этим веществом является жидкость, то трение вызывает эффект, называемый вязкостью. Т.о., вязкость - это внутреннее трение, проявляющееся при относительном движении соседних слоев жидкости и зависящее от сил сцепления (взаимодействия) между молекулами.
Во всех жидкостях при перемещении одних слоев относительно других возникают более или менее значительные силы трения, направленные по касательной к поверхности этих слоев. Сила внутреннего трения F прямо пропорциональна площади S трущихся друг о друга слоев жидкости и скорости их движения DV и обратно пропорциональна расстоянию этих слоев Dl один от другого:
 |
h (ита) - коэффициент вязкости или коэффициент внутреннего трения, зависит от природы жидкости и ее температуры (с повышением Т вязкость понижается).
Вязкость является величиной, характерной для данной жидкости.
Значение вязкости в природе очень велико. В биологических системах она влияет на протекание ряда важнейших процессов в живом организме.
Вязкость жидкости определяется прибором – вискозиметром, на котором определяют время истечения данного объёма жидкости (V) между метками а и b на капиллярной трубке через вертикальный капилляр под действием силы тяжести.
Вискозиметр Оствальда

С учетом того, что разность давлений между концами U-образной трубки (P) прямо пропорциональна плотности жидкости, а радиус (R) и длина (l) капилляра известна, находят время истечения жидкости (t):
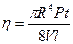 |