Молярная концентрация эквивалента
(нормальная концентрация или нормальность) С(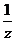 х) или СН(х)
х) или СН(х)
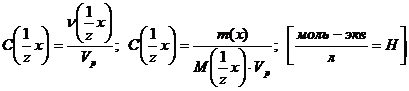


Молярная концентрация эквивалента всегда больше молярной концентрации в z раз.
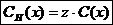 .
.
Титр раствора Т(х)
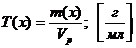
5) Моляльная концентрация вещества (моляльность) Сm(х) или в(х)
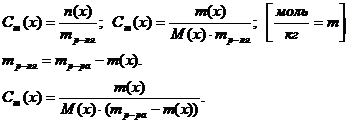
Молярная доля вещества в растворе N(х) или Х(х)
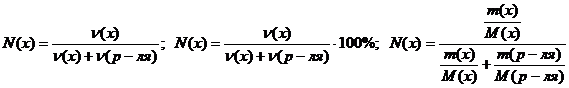 .
.
Образец 1. Вариант 0
1. Определите молярную концентрацию раствора, содержащего 33,0 г сульфид калия в 200мл водного раствора.
2. 50 г вещества растворили в 150мл воды. Определите массовую долю вещества в растворе
3. Для растворов каких веществ верно соотношение Сн=3См
а) Al2(SO4)3 б) FeCl3 в) HCl г) H3PO4 д) Ca(OH)2
4. Чему равна нормальная концентрация раствора FeCl2 с массовой долей 25% (плотность раствора =1,016 г/мл)?
5. Определите процентную концентрацию раствора сульфата натрия с моляльной концентрацией 0,5моль/кг.
6. Сколько миллилитров 0,2Н раствора HCl потребуется для реакции с 15мл 0,075М раствора Вa(OH)2? Задачу решить с использованием закона эквивалентов.
Образец 2.Вариант 0
1.Найти молярную концентрацию эквивалента 90%-ного раствора серной кислоты, плотность раствора 1,67 г/мл.
2а. Раствор бромоводородной кислоты с концентрацией 0,7моль/л смешали с равным объемом раствора иодоводородной кислоты с концентрацией 0,5моль/л. Чему равны молярные концентрации этих веществ в образовавшемся растворе.
2б. Смешали два раствора соляной кислоты — один с молярной концентрацией 0,05М и объемом 350мл, другой раствор объемом 0,2л с молярной концентрацией 0,1М. Найти молярную концентрацию образовавшегося раствора.
3.Рассчитайте, какой объем концентрированного раствора уксусной кислоты (w=36%, ρ=1,049г/мл) потребуется для приготовления 1100мл разбавленного раствора с молярной концентрацией 0,4моль/л.
4.Для нейтрализации раствора, содержащего 2,25 г кислоты, потребовалось 25 мл 2,0 Н раствора щёлочи. Определите эквивалентную массу кислоты. Что это за кислота?
Возможные варианты решения задач.
Примеры задач с решениями по теме «Способы выражения концентраций растворов»
Пример1. В какой массе эфира надо растворить 3,04г анилина C6H5NH2, чтобы получить раствор, моляльность которого 0,3 моль/кг?
Решение.
Моляльная концентрация раствора Сm (моль/кг) показывает количество растворенного вещества, находящегося в 1кг растворителя:
Сm (в-ва) = n(в-ва) / m(р-ля),
Где n(в-ва) – количество растворенного вещества, моль;
m- масса растворителя, кг.
Масса растворителя (эфира) рассчитывается по формуле:
m(р-ля) = n(C6H5NH2) / Сm (C6H5NH2); n(C6H5NH2)= m(C6H5NH2) / M(C6H5NH2);
M(C6H5NH2) = 93 г/моль.
Тогда m(эфира) = 3,04г / (93 г/моль· 0,3 моль/кг) = 0,109 кг
Ответ: m(эфира) = 0,109 кг.
Пример2. Определить титр раствора в 100мл которого содержится 2г едкого натра.
Решение.
Титр раствора показывает массу (г) растворенного вещества m(в-ва), содержащегося в 1мл раствора V(р-ра):
T = m(в-ва) / V(р-ра).
Титр этого раствора равен: Т = 2г / 100мл = 0,02г /мл.
Ответ: Т(NaOH) = 0,02 г/мл
Пример 3. Вычислите молярную, нормальную (молярную концентрацию эквивалента), моляльную концентрации 8% раствора 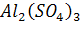 (плотность раствора 1100 кг/м3). Определите титр и молярную долю
(плотность раствора 1100 кг/м3). Определите титр и молярную долю 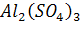 в растворе.
в растворе.
Решение.
Вспомним формулы концентраций:
1)  ; 2)
; 2) 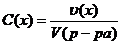 ; 3)
; 3) 
 ;
;


Ни в одной из записанных формул, не знаем двух величин, можем принять какой-либо параметр за х, а в данном случае не знаем ни массы ни объема, то можно принять и за конкретное число.
Пусть Vр-ра=1 л (1000мл)
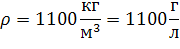
Тогда m(р-ра)= 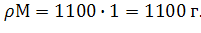
Из (1): 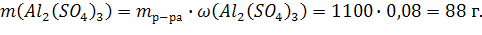
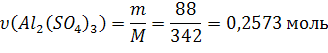
По (2): 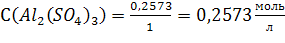

По (3): 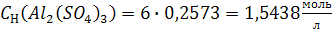

По (4): 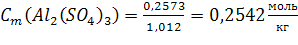
По (5): 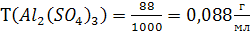
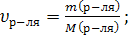 р-ль – H2O, т.к. о нем ничего не говорится. По (6):
р-ль – H2O, т.к. о нем ничего не говорится. По (6): 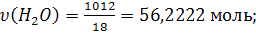 N
N 
Ответ: С(Al2(SO4)3) = 0,2573моль/л; СН(Al2(SO4)3) = 1,5438 моль/л;
С(Al2(SO4)3) = 0,2542моль/кг; Т(Al2(SO4)3) = 0,088г/мл; N(Al2(SO4)3) = 0,46%
Пример 4. Рассчитать молярную и молярную концентрацию эквивалента раствора мышьяковой кислоты (H3AsO4). Плотность раствора 1,08 г/мл, массовая доля H3AsO4 9%.
Решение:
Фактор эквивалентности H3AsO4 = 
С(H3AsO4) = 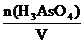 С(
С( H3AsO4) =
H3AsO4) =  = 3С(H3AsO4)
= 3С(H3AsO4)
Объем раствора принимаем равным 1 л = 1000 мл.
m(H3AsO4) = V·ρ·ω(H3AsO4) = 1000·1,08·0,09 = 97,2 г
n(H3AsO4) = 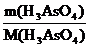 =
=  = 0,68 моль
= 0,68 моль
С(H3AsO4) = 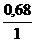 = 0,68 моль/л; С(
= 0,68 моль/л; С( H3AsO4) = 3·0,68 = 2,04 моль/л
H3AsO4) = 3·0,68 = 2,04 моль/л
Ответ: С(H3AsO4) = 0,68 моль/л, С( H3AsO4) = 2,04 моль/л
H3AsO4) = 2,04 моль/л
Пример 5. Рассчитать массовую долю 1,25 н. раствора фосфорной кислоты, если плотность раствора составляет 1,05 г/мл.
Решение:
ω(H3PO4) = 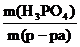
Объем раствора принимаем за 1 л (1000 мл). Тогда масса раствора равна:
m(р-ра) = V·ρ = 1000·1,05 = 1050 г
Фактор эквивалентности H3PO4 = 
Количество вещества: n( H3PO4) = C(
H3PO4) = C( H3PO4)·V = 1,25·1 = 1,25 моль
H3PO4)·V = 1,25·1 = 1,25 моль
Масса H3PO4 в растворе:
m(H3PO4) = n( H3PO4)·M(
H3PO4)·M( H3PO4) = n(
H3PO4) = n( H3PO4)·
H3PO4)·  ·M(H3PO4)
·M(H3PO4)
m(H3PO4) = 1,25·  ·98 = 40,83 г
·98 = 40,83 г
Массовая доля H3PO4 в растворе:
ω(H3PO4) = 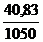 = 0,039 или 3,9%
= 0,039 или 3,9%
Ответ: ω(H3PO4) = 0,039 или 3,9%.
Пример6. Рассчитайте мольные доли глюкозы и воды в растворе с массовой долей глюкозы 36%.
Решение.
Мольная доля вещества в растворе (N(в-ва)) равна отношению количества данного вещества к общему количеству всех веществ, содержащихся в растворе. Если в раствор содержит одно растворенное вещество, тогда:
N (в-ва) = n(в-ва) / (n(в-ва)+ n(р-ля)).
В данном случае в 100г раствора с массовой долей глюкозы, равной 36%, содержится 36г глюкозы и 64г воды (100г - 36г = 64г).
Определяем количество глюкозы и воды:
n(C6H12O6) = m(C6H12O6) / M(C6H12O6) = 36г /180г/моль =0,2моль;
n(H2O) = m(H2O) / M(H2O) = 64г /18г/моль =3,56моль;
n(C6H12O6) + n(H2O) =0,2 + 3,56 = 3,76моль.
Рассчитываем мольные доли глюкозы и воды:
N(C6H12O6) = 0,2 / 3,56 = 0,053 = 5,30%
N(H2O) = 3,56 / 3,76 = 0,947 = 94,7%
Ответ: N(C6H12O6) = 5,30%; N(H2O) = 94,7%
Пример7. Вычислите молярную концентрацию эквивалента, молярную концентрацию и моляльность раствора, в котором массовая доля сульфата меди(II) равна 10%. Плотность раствора 1,107г/мл.
Решение:
Определим молярную массу и молярную массу эквивалента CuSO4 :
М(CuSO4) = 160г/ моль; М(1/2CuSO4) = 160/(1·2) =80 г/ моль.
Пусть масса 10%-ного раствора была 100г,
тогда в нем содержится 10г CuSO4 и 90г воды(0,09кг).
Определим количество моль соли
n(CuSO4) = m(CuSO4) / М(CuSO4) = 10г/160г/моль =0,0625моль.
Определим количество моль эквивалента соли:
n(1/2CuSO4) = m(CuSO4) / М(1/2CuSO4) = 10г/80г/моль =0,125моль.
Следовательно, моляльная концентрация равна:
Сm = 0,0625моль/ 0,09кг = 0,694моль/кг.
Для расчета молярной концентрации и молярной концентрации эквивалента необходимо рассчитать объем раствора (л). Зная массу раствора (100г) и плотность, находим:
V(р-ра) = m (р-ра)/ ρ (р-ра) =100г / 1,107г/мл = 90,3мл = 0,0903л.
Тогда молярная концентрация:
С (CuSO4) = n(CuSO4) / V(р-ра) = 0,0625 моль/ 0,0903л= 0,692 моль/л
Молярная концентрация эквивалента:
С (1/2CuSO4) = n(1/2CuSO4) / V(р-ра) = 0,125 моль/ 0,0903л= 1,384 моль/л.
Ответ: C(CuSO4) = 0,692моль/л; C(1/2CuSO4) = CН(CuSO4) = 1,384моль/л;
Сm(CuSO4) = 0,694 моль/кг.
Пример8. Сахар массой 300 г растворили в воде объемом 4,5 л. Найти массовую долю (%) сахара в этом растворе.
Решение.
Массовая доля – это отношение массы вещества к массе раствора:
 или
или 
mр = m(x) + m(р-ля);
Масса воды (растворителя):
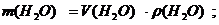 ρ(H2O) = 1000г/л (или 1,0 кг/л или 1,0 г/мл);
ρ(H2O) = 1000г/л (или 1,0 кг/л или 1,0 г/мл);
m(H2O) = 4,5∙ 1,0 = 4,5 кг = 4500 г
Масса раствора:
mр = m(сахара) + m(воды) = 300 + 4500 = 4800 г
Массовая доля:
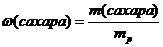
 = 0,0625 или 6,25%
= 0,0625 или 6,25%
Ответ: ω(сахара) = 6,25 %