ЛЕКЦИЯ 6.
1.От атома к новым материалам, или кое-что о современной химии. Понятие о концептуальных системахв развитии химии. Синтез веществ с заданными свойствами. Новые подходы в синтезе неорганических материалов.
2. Химические свойства атома. Виды химической связи. Атомное строение тел. Различные состояния вещества (газ,жидкость,твердое тело,плазма).
1.От атома к новым материалам, или кое-что о современной химии. Понятие о концептуальных системахв развитии химии. Синтез веществ с заданными свойствами. Новые подходы в синтезе неорганических материалов.
Следуя подходу о концептуальных системах в развитии химии можно выделить четыре этапа:
I. Учение о составе.
II. Структурная химия.
III. Учение о химическом процессе.
IV. Эволюционная химия.
Первая концептуальная система – «Учение о составе»: свойства вещества определяются его составом, то есть тем, из каких химических элементов и в каком их соотношении образовано данное вещество.
Вторая концептуальная система – «Структурная химия»: свойства вещества определяются не только составом, но и порядком соединения атомов между собой и их расположением в пространстве, т.е. структурой объекта.
Третья концептуальная система – «Учение о химическом процессе»: свойства вещества определяются не только его составом и структурой, но и организацией системы, в которой это вещество находится. Иными словами, необходимо учитывать внешние условия и возможное участие в «жизни» системы веществ, напрямую «не участвующих» в химической реакции (катализаторы, растворители, примеси).
Четвертая концептуальная система – «Эволюционная химия»: свойства вещества определяются не только его составом, структурой, «технологией», но и процессами самоорганизации вещества. Такой подход только формируется и далек от завершения; он связан с включением в химическую науку необходимости изучения формирования веществ в неживой и живой природе в течение миллионов (а возможно, и миллиардов) лет, с построением теории химической эволюции материи.
В последние годы в мире много говорят о «зеленой» химии. Это связано с необходимостью в привлечении внимания как ученых-химиков, так и общественности к совершенствованию технологических процессов для защиты окружающей среды.
Ограниченность курса «Концепции современного естествознания» не позволяет остановиться подробно на всем многообразии химических подходов и задач, поэтому сосредоточимся лишь на одной из основных проблем – синтезе (получении) веществ с заданными свойствами. Для решения этого вопроса необходимо разобраться в том, какие основные факторы определяют свойства вещества. В этом нам поможет подход о концептуальных системах, упомянутый выше. В новом преломлении он выглядит следующим образом:

|
Для «полного счастья» необходимо знать и "способ приготовления" материала. Например - дамасская сталь, способ изготовления которой был утерян на долгие годы и воспроизведен лишь в конце XX века

В Дели, во дворе мечети Кувватуль-Ислам, уже сотни лет стоит и не ржавеет железная колонна (а мы привыкли, что «железо» автомобилей ржавеет очень быстро, за пару сезонов).

Сегодня ученые обращают внимание на необычные свойства материалов, полученных природой - например, очень крепкие нити паутины или очень надежные архитектурные коралловые постройки. Поэтому современная химия пытается раскрыть эти эволюционные тайны, чтобы создать прочные искусственные волокна. Оказалось, что одиночная нить, производимая пауком, по прочности не уступает стальной проволоке равного диаметра (но плотность стали в шесть раз больше, чем паутины). Канат, сплетенный из паутины, толщиной всего примерно с карандаш, мог бы удержать на месте бульдозер, танк или железнодорожный состав.
2. Химические свойства атома. Виды химической связи. Атомное строение тел. Различные состояния вещества (газ,жидкость,твердое тело,плазма).
Начнем более подробное обсуждение вышеозвученных положений. В основе всех подходов – состав материалов, т.е. атомы и молекулы, из которых состоит все материальное в нашем мире.
Напомним, что атом - квантово-механическая система, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки

На сегодня атомы обозначаются следующим стандартным образом:  , где S - символ атома, Z - атомный номер, равный числу протонов (т.е. заряду ядра), A=Z+N - массовое число, где N - число нейтронов. Таким образом, массовое число показывает полное число нуклонов. Ясно, что изотопы химических элементов имеют ядра с разным числом нейтронов, следовательно, различаются их массовые числа. В качестве примера приведем некоторые сведения об изотопах урана:
, где S - символ атома, Z - атомный номер, равный числу протонов (т.е. заряду ядра), A=Z+N - массовое число, где N - число нейтронов. Таким образом, массовое число показывает полное число нуклонов. Ясно, что изотопы химических элементов имеют ядра с разным числом нейтронов, следовательно, различаются их массовые числа. В качестве примера приведем некоторые сведения об изотопах урана:
Изотопы урана
| Изотопы урана | Число протонов | Число нейтронов | Распространенность в земной коре, % | Период Полураспада, годы | Тип распада |
| 0,0057 | 2.45.105 | a | |||
| 0,72 | 7.13.108 | a | |||
| 99,27 | 4.49.109 | a |
В природных условиях радиоактивность урана обусловлена изотопом 234U.
Химические элементы, особенно их сочетания, во многом определяют свойства вещества, что отчетливо проявляется для многоатомных соединений. Например, рассмотрим ряд на основе водорода: H2, H2O, HCl, CH4,. Первое соединение из двух атомов водорода - газ, второе – вода, получается при присоединении к двум атомам водорода одного атома кислорода, третье соединение - добавили водороду атом хлора и получили газ, при растворении в воде образующий соляную кислоту, четвертое - углеводород, состоящий из углерода и водорода и т.п. (естественно, все вещества находятся при нормальных условиях).
Многие (но далеко не все!) свойства химических элементов, а тем более соединений можно получить из анализа «таблицы Менделеева».
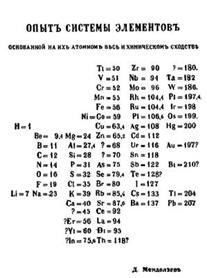
| 
|
| Периодическая система химических элементов, предложенная Д.И. Менделеевым (слева) и современный вид (справа) |
Не вдаваясь в детали, известные из школьных курсов химии и физики, вспомним строение нескольких первых атомов:
| Химический элемент | Z | Число электронов на 1-й оболочке | Число электронов на 2-й оболочке | Число электронов на 3-й оболочке | Свойства |
| Водород | Активный газ | ||||
| Гелий | 2 (заполнена) | Инертный газ | |||
| Литий | Активный металл | ||||
| Бериллий | 2 (заполнена) | ||||
| Бор |
(Задание: возьмите таблицу Менделеева и проанализируйте разбиение элементов по столбцам и линиям).
Химические свойства атома (то есть то, какого рода связи будут образованы с другими атомами) определяются числом электронов в наружном слое. Так, у водорода и лития только по одному внешнему электрону, поэтому в химических реакциях они ведут себя похоже. В свою очередь, гелий и неон оба имеют заполненные внешние оболочки, и тоже ведут себя похоже, но совершенно не так, как водород и литий.
Окружающий нас мир состоит из 92 элементов (в 1930-е годы они все уже были открыты) — от водорода (атомный номер Z=1) до урана (Z=92), которые представлены 287 стабильными изотопами, т.е. химические элементы вплоть до урана (содержит 92 протона и 92 электрона) встречаются в природе.Начиная с номера 93 идут искусственные элементы, созданные в лаборатории. К середине 1990-х годов было синтезировано уже 109 элементов (открыты тяжелые трансурановые элементы, которые живут очень короткое время). Время жизни радиоактивных изотопов уменьшается до тех пор, пока существует ядро атома: расчеты показывают, что может существовать около 5000 радиоактивных ядер.
Названия новым элементам даются в честь великих ученых или названий мест расположения научных центров: 101-й элемент – менделевий, 102-й - нобелий, 103-й - лоуренсий, 104-й - дубний, 105-й - жолиотий, 106-й - сиборгий, 107-й - борий, 108-й - хассий, 109-й – мейтнерий, 110-й – дармштатдий, 111-й - рентгений, 112-й – коперникийи т.д.
Пока самый большой заявленный учеными номер — 118. У любознательного студента может возникнуть вопрос: а сколько всего может быть элементов? Элементы, стоящие в таблице за ураном, - искусственного происхождения. Чем выше их атомный номер, тем быстрее они распадаются. Но жизнь сверхтяжелых элементов стала, напротив, увеличиваться – появились "острова стабильности". С другой стороны, казалось бы, можно оценить электростатические силы притяжения внутренних электронов атомов к положительно заряженному ядру. Для тяжелых элементов, имеющих большой заряд ядра, электронная «шуба» сильнее сжимается, сильнее притягиваются внутренние электроны к ядру и электроны начнут захватываться ядром. Но законы квантовой механики показывают, что нет ограничений для существования очень тяжелых элементов с точки зрения представлений о строении электронных оболочек. Ограничения возникают в результате неустойчивости самих ядер.
Перейдем от разрозненных химических элементов к химическим соединениям, чтобы понять, чем определяются свойства материалов. Напомним, что химическое соединение - это вещество, состоящее из атомов одного или нескольких сортов, которые объединены в частицы - молекулы, комплексы, кристаллы или иные агрегаты. Различают соединения постоянного состава (дальтониды) и переменного (бертоллиды).
Молекула - наименьшая частица вещества, которая полностью определяет его свойства и в то же время существует самостоятельно.
Причина образования химических соединений заключается в различной физической природе химических сил, объединяющих атомы в молекулу как единую квантово-химическую систему. Химическая связь обусловлена обменным взаимодействием электронов (обобщение валентных электронов). Теперь химическое соединение можно трактовать как вещество, состоящее из одного или нескольких химических элементов, атомы которых за счет обменного взаимодействия (химической связи) объединены в частицы - молекулы, комплексы, монокристаллы или иные агрегаты. Укажем, что химическое соединение может состоять и из атомов одного элемента например, кислород, алмаз и т.л.
Различают четыре вида химической связи - ионную, ковалентную, металлическую и водородную.
Ионная связь
Ионная связь: один из атомов легко отдает электрон с внешней оболочки, а атом другого сорта легко принимает к себе этот электрон. Образовавшиеся ионы (катион - положительно заряженная частица и анион - отрицательно заряженная) за счет сил электростатического взаимодействия притягивают друг друга. Например, в кристалле NaCl катионы Na+ притягивают анионы Cl-.
 
|
| Пример ионной связи |
Ковалентная связь
Ковалентная связь: ни один из атомов не может полностью отдать электрон. В этом случае происходит частичное “объединение” электронов, т.е. электрон проводит часть времени у “своего” старого ядра, а часть времени - у нового.
 
|
| Пример ковалентной связи |
Металлическая связь
Металлическая связь: в этом случае происходит полное обобществление электронов, ядра как бы находятся в “электронном газе” (или “жидкости”). При этом электроны могут легко двигаться, что и объясняет малое электрическое сопротивление металлов.
 
|
| Пример металлической связи |
Водородная связь
Водородная связь: проявляется как результат взаимодействия атома водорода с электроотрицательным атомом и неподеленной парой электронов другого атома. Водородная связь приводит к ассоциации одинаковых или различных молекул в различные комплексы; она во многом определяет свойства воды и льда, молекулярных кристаллов, структуру и свойства белков, нуклеиновых кислот и др.

|
| Пример водородной связи |
В природе перечисленные типы связей в «чистом виде» проявляются редко, в большинстве соединений имеет место наложение разных типов связей.
Атомное строение тел. Различные состояния вещества.
Кроме того, что свойства соединения зависят от его состава, очевидно, что большое значение имеет атомное строение тел, т.е. расположение атомов в пространстве. Действительно, напомним самый простой пример: хотя вода и лед имеют один и тот же химический состав, свойства их существенно различны.
Очевидно, что с понятием структуры связаны и агрегатные состояния вещества. Большинство веществ может существовать в трёх агрегатных состояниях — твёрдом, жидком и газообразном. Например – вода, которая при обычном давлении (p= 760 мм рт.ст.) может находиться в виде льда (при t < 0ОС), жидкости (от нуля до 100ОС) и водяного пара (при t>100OC).
Четвёртым агрегатным состоянием вещества считают плазму.
Переход из одного агрегатного состояния вещества в другое сопровождается скачкообразным изменением расстояний между молекулами (атомами) (и, как следствие) межмолекулярных взаимодействий. Как известно, в любом веществе его частицы (молекулы, атомы) находятся в непрерывном движении, и степень (интенсивность) этого движения характеризует температура. С другой стороны, эти частицы взаимодействуют между собой благодаря наличию химических связей. При низких температурах энергия связей частиц больше энергии тепловых колебаний частицы, частицы не могут «удалиться» друг от друга на большие (конечно, по сравнению с размерами атомов, т.е. 10-8см) расстояния - вещество существует в твердом состоянии. Зачастую частицы образуют правильную геометрическую структуру, в таком случае, говорят о кристаллической структуре. У твёрдых тел в кристаллообразном состоянии атомы совершают только колебания около равновесных положений, или узлов кристаллической решётки; структура этих тел характеризуется высокой степенью упорядоченности — дальним и ближним порядком. Если дальний порядок отсутствует, то имеем аморфное состояние (например, стекло).

|
| Агрегатные состояния вещества |
При повышении температуры энергия тепловых колебаний частиц возрастает, энергия тепловых колебаний увеличивается и энергии связей уже недостаточно, чтобы удерживать частицы. Связи между частицами постоянно разрушаются и вновь образуются, частицы начинают двигаться не только около положений равновесия, но и перемещаться на достаточно большие расстояния. Однако они еще остаются в контакте, хотя правильная геометрическая структура частиц нарушается — вещество существует в жидком состоянии. Иными словами, молекулы (атомы) колеблются около положений равновесия и совершают перескоки из одного положения равновесия в другое. При этом в жидкостях наблюдается порядок только в расположении ближайших частиц (ближний порядок, в отличие от дальнего порядка в кристаллах), а также свойственные им подвижность и текучесть.
При дальнейшем повышении температуры тепловые колебания увеличиваются, в результате молекулы практически не взаимодействуют друг с другом и движутся фактически свободно, заполняя весь объём. Вещество переходит в газообразное состояние. В “идеальном” газе частицы свободно перемещаются во всех направлениях.
Если еще сильнее повысить температуру (до тысяч или даже десятков тысяч градусов, то удастся «разрушить» атомы и перевести вещество в четвертое состояние - плазму, которая представляет собой газ, состоящий из смеси нейтральных и ионизованных молекул и электронов. Таким образом, при переходах твердое тело ® жидкость ® газ ® плазма происходит «уничтожение» порядка на различных уровнях.
Указанные четыре основные состояния вещества - плазменное, газообразное, жидкое и твердое (перечисленные в порядке существования при понижении температуры), известны давно, однако на сегодня ученые выделяют еще два состояния – низкотемпературные конденсаты. Конденсат - новое состояние вещества при сверхнизких температурах - меньше 0.00000001 К (!!!), т.е. при температурах ниже температуры космического вакуума (в космосе температура около 3 К).
Спасибо, что ознакомились с еще одной интересной темой.