Скорость химических реакций


∆с=с2-с1, с-молярная концентрация (моль/л)
∆t=t2-t 1, t-время (сек, мин, часы и т.д)
Рассмотрим, когда перед дробью ставится знак «+», а когда «-»
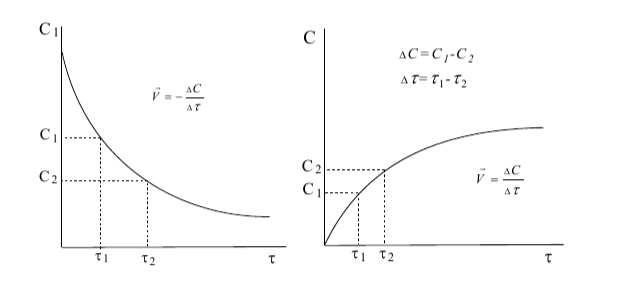
Первый график: А +В=С (скорость реакции рассчитываем относительно реагенов).
В начальный момент времени концентрация вещества А максимальная, с течением времени она уменьшается, поэтому значение ∆с=с2-с1 отрицательно. Но так как скорость реакции не может быть отрицательной, перед дробью ставим знак «-», потому что минус на минус дает плюс.
Второй график:А+В= С (скорость реакции рассчитываем относительно продукта реакции).
В начальный момент времени концентрация вещества С равна нулю, с течением времени она увеличивается, поэтому значение ∆с=с2-с1 положительно. Перед дробью ставим знак «+».


Задача 1.




Зависимость скорости реакции от различных факторов.
1. От концентрации: при увеличении концентрации реагирующих веществ скорость химической реакции увеличивается.

Эта зависимость подчиняется закону «действующих масс»:
для реакции 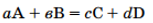
по закону «действующих масс» скорость рассчитывается: 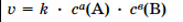 или
или 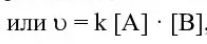
k- коэффициент скорости. Он не зависит от концентрации. То есть, как бы не изменялась скорость химической реакции, коэффициент скорости будет всегда один и тот же.
В это уравнения входят вещества, находящиеся в жидком или газообразном состояниях. Для веществ, находящихся в твердом состоянии, реакция идет на поверхности твердого вещества.

!!!! Если в задаче даны концентрации (жидкие или газообразные вещества) или давление (оно связано с концентрацией), то работаем с формулой закона «действующих масс».


3.77. уменьшиться в 10 раз.
2. От температуры: при увеличении температуры скорость химической реакции увеличивается.
Эта зависимость подчиняется правилу Вант- Гоффа:



От природы реагирующих веществ.
 Если надо сравнить активность металлов, то необходимо смотреть в ряд активности металлов.
Если надо сравнить активность металлов, то необходимо смотреть в ряд активности металлов.

Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.
4. Для веществ, находящихся в твердом агрегатном состояниях, скорость реакции зависит от площади соприкосновения твердых веществ. Для ее увеличения вещества необходимо либо измельчить, либо перемешать.

Задание ЕГЭ:

Зависимость скорости реакции от катализаторов и ингибиторов.
Катализатор - вещество, изменяющее скорость химической реакции, но остающееся неизменным после того, как химическая реакция заканчивается.
Влияние катализаторов на скорости реакций называется катализом.
Механизм действия катализаторов (упрощенный).
В ходе катализируемой химической реакции происходит образование промежуточных продуктов (образование связи между катализатором и реагирующим веществом).
А +В = АВ,
Реакция без катализатора идет очень медленно, а при добавлении катализатора К, о реагирует с одним из исходных веществ (например, с А), образуя очень непрочное и реакционноспособное промежуточное соединение АК:
А + К = АК,
Это промежуточное соединение реагирует с другим исходным веществом В, образуя конечный продукт АВ и катализатор выходит в первоначальном виде:
АК + В = АВ + К.
Каталитические реакции в неорганической химии (для ЕГЭ)
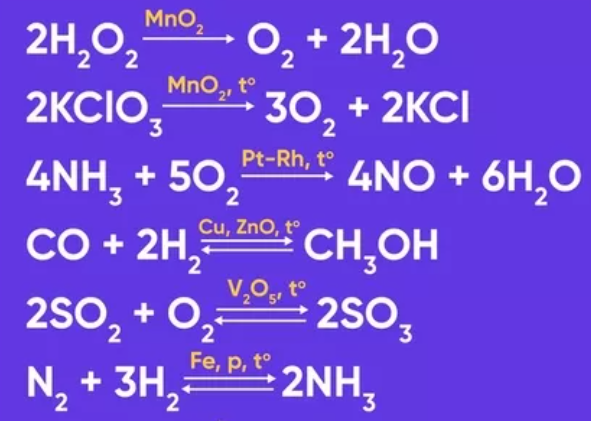
ИНГИБИ́ТОРЫ ХИМИ́ЧЕСКИХ РЕА́КЦИЙ- вещества, в присутствии которых скорость химической реакции уменьшается или реакция прекращается.