Химическая кинетика
126. Учитывая, что при разложении 2 моль аммиака на простые вещества поглощается 92 кДж теплоты, укажите величину теплоты образования 1 моль аммиака. 46 кДж
127. Что такое энергия активации? Минимальное количество энергии,которое требуеться сообщить системе чтобы произошла реакция
128. На основании термохимического уравнения  кДж укажите величину теплового эффекта реакции образования 1 моль оксида Аl. 1600 кДж
кДж укажите величину теплового эффекта реакции образования 1 моль оксида Аl. 1600 кДж
129. Как меняется энтальпия в экзотермической реакции? - ∆H
130. Чему равны стандартные энтальпии образования простых веществ? 0
131. Какая из приведенных реакций является экзотермической? ∆H < 0
132. Экспериментально теплоты сгорания (а также энтальпии образования) определяют в специальном приборе, называемом калориметр
133. На основании термохимического уравнения  кДж, определите, какая масса углерода сожжена, если выделилось 206 кДж теплоты? 6г
кДж, определите, какая масса углерода сожжена, если выделилось 206 кДж теплоты? 6г
134. Учитывая термохимическое уравнение  укажите величину теплового эффекта реакции разложения 8 г оксида серы (ҮІ). 9,9
укажите величину теплового эффекта реакции разложения 8 г оксида серы (ҮІ). 9,9
135. На основании термохимического уравнения  определите, какой объем при н.у. займет молекула азота, если поглотится 45 кДж теплоты? 5,6л
определите, какой объем при н.у. займет молекула азота, если поглотится 45 кДж теплоты? 5,6л
136. На основании термохимического уравнения  определите, какой объем при н.у. займет водород, если выделилось 450 кДж теплоты. 336л
определите, какой объем при н.у. займет водород, если выделилось 450 кДж теплоты. 336л
137. Как обозначают стандартные тепловые эффекты? ∆Н0298
138. В каких единицах может выражаться скорость химической реакции? Моль л-1с-1
139. Какова размерность константы скорости для реакции первого порядка? с-1
140. Работы каких ученых в наибольшей степени способствовали выявлению
зависимости константы скорости химической реакции от температуры? Аррениус и Вант - Гоффа
141. Во сколько раз надо увеличить давление, чтобы скорость реакции

возросла в 1000 раз? 10
142. Как называются вещества, ускоряющие скорость химической реакции? катализаторы
143. какие вещества называют катализаторам? Изменяющие скорость химической реакции, но сами не изменяються в конце реакции
144. Как называется раздел химии, изучающий скорости и механизмы химических реакций? Химическая кинетика
145. Во сколько раз увеличится скорость реакции  при увеличении концентрации вещества
при увеличении концентрации вещества  в 3 раза? 3раза
в 3 раза? 3раза
146. Как изменится скорость реакции  при уменьшении концентрации вещества
при уменьшении концентрации вещества  в 2 раза? Уменьшиться в 4раза
в 2 раза? Уменьшиться в 4раза
147. Какое уравнение описывает зависимость скорости реакции V от температуры Т(g - температурный коэффициент реакции)? Ʋ2=Ʋ1 γt2-t1/10
148. Во сколько раз надо увеличить внешнее давление в системе, чтобы скорость реакции А(г)+2В(г)=С(г) увеличилась в 125 раз? 5 раз
149. Как изменится скорость реакции, протекающей по уравнению 
при увеличении концентрации водорода в 3 раза? Увеличиваеться в 9раз
150. Напишите математическое выражение для скорости реакции, протекающей по уравнению  . Ʋ= к [NH3]4[O2]5
. Ʋ= к [NH3]4[O2]5
151. Какой формулой запишется закон действия масс для реакции, протекающей по уравнению  ? Ʋ= к[O2]
? Ʋ= к[O2]
152. Во сколько раз возрастет скорость химической реакции при увеличении температуры на 20˚С, если температурный коэффициент равен 2? 4раза
153. Во сколько раз увеличится скорость реакции при повышении температуры от 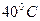 до
до  , если температурный коэффициент реакции равен 3? 27раз
, если температурный коэффициент реакции равен 3? 27раз
154. Во сколько раз увеличится скорость реакции при повышении температуры от  до
до  , если температурный коэффициент реакции равен 2? 16раз
, если температурный коэффициент реакции равен 2? 16раз
155. Во сколько раз возрастет скорость химической реакции при увеличении температуры на 40˚С, если температурный коэффициент равен 2? 16раз
156. Чему равен температурный коэффициент, если при увеличении температуры на 30˚С скорость химической реакции возрастет в 27 раз? 3
157. Какой формулой определяется скорость прямой химической реакции Sтв.+O2®SO2? Ʋ= к[O2]
158. Во сколько раз увеличится скорость реакции  , если увеличить концентрацию реагирующих веществ в 2 раза? 8раз
, если увеличить концентрацию реагирующих веществ в 2 раза? 8раз
159. Для реакции  укажите кинетическое уравнение для прямого процесса.
укажите кинетическое уравнение для прямого процесса.
Ʋ= к [А2][В2]
Химическое равновесие
160. В каком направлении сместится равновесие 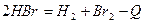 при увеличении концентрации водорода? ß влево
при увеличении концентрации водорода? ß влево
161. Какие факторы смещают равновесие

вправо? Увеличение концентрации SO2
162. Какие факторы сместят вправо равновесие  ? Умен Р или
? Умен Р или
Увеличение t
163. Какие факторы сместят равновесие влево  ? Умен Р или
? Умен Р или
Увеличение t
164. Какие факторы сместят равновесие вправо  ? Умен t или
? Умен t или
Увеличение P
165. Как записывается для обратимых реакций общего вида аА + вВ ↔ dD + +eE константа равновесия К в cоответствии с законом действующих масс для равновесия? 
166. Как меняются при достижении химического равновесия концентрации веществ? Не меняеть
167. Как влияет увеличение объема сосуда на равновесие:
 ? Не влияет
? Не влияет
168. Как повлияет на состояние равновесия реакции 
понижение температуры? Вправо –>
169. В каком направлении сместится равновесие процесса  при внесении в систему катализатора? Не сместится ни в каком
при внесении в систему катализатора? Не сместится ни в каком
170. Как смещает равновесие процессов изменение давления? увелич Р→в сторону меньшего умень Р←в сторону большего
171. Изменение давления смещает равновесие каких процессов? 2Н2+О2=2Н2О2
172. В каком направлении сместится равновесие процесса 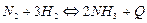 при увеличении температуры? ß влево
при увеличении температуры? ß влево
173. Выберите правильный ответ для константы равновесия данной реакции. Кр= [NH3]^2/[N2]*[H2]^3
174. Для какого процесса будет характерно состояние равновесия? Синтез аммиака
175. Какая реакция является необратимой: цинк с сульфатом меди
176. В какую сторону сместится равновесие экзотермической реакции при нагревании? ß влево
177. В какую сторону сместится равновесие реакции разложения вещества при увеличении давления в системе? в сторону меньшего числа
178. В какую сторону сместится равновесие обратимого процесса, если увеличить концентрации исходных веществ? вправо
179. Выберите правильный ответ для записи константы химического равновесия для реакции:  Кр= [HCL]^2/ [H2]*[Cl2]
Кр= [HCL]^2/ [H2]*[Cl2]
180. Уравнение обратимой реакции: А + 2В ® 2С. В каком направлении сместится равновесие реакции при увеличении давления (все вещества газы)? вправо
181. Указать правильное выражение для константы химического равновесия системы  . Кр= [SO2]^2[O2]/[SO3]^2
. Кр= [SO2]^2[O2]/[SO3]^2
182. В каком направлении сместится равновесие обратимой реакции: А + 2В ® 2С при увеличении давления (все вещества газы)? вправо
183. В какую сторону сместится равновесие экзотермической реакции 2СО®СО2 + Q при понижении температуры? вправо
184. В каком направлении сместится равновесие экзотермической обратимой реакции при увеличении температуры? влево
185. Выберите правильный ответ для константы равновесия данной реакции: 2NH3«N2+3H2 . Кр= [N2]*[H2]^3/[NH8]^2
186. Выберите правильный ответ для константы химического равновесия реакции: N2(г)+О2(г) «2NO. Кр= [NO]^2/[N2]*[O2]
Модуль 4
Растворы
187. Как называются вещества, способные к образованию растворов, делят на две категории, называемые, в зависимости от того, проводят или не проводят их растворы (расплавы) электрический ток? электролиты и не электролиты
188. Что такое электролиты? Это вещество которое проводять электрический ток.
189. Как называют положительные ионы? Катьоны
190. Как называется самопроизвольный распад молекул растворенного (иногда – расплавленного) вещества на катионы и анионы? электролитическая диссоциация
191. Что такое степень диссоциации? Отношение расспавшихся ко всему количеству
192. Какое вещество относится к слабым электролитам? Гидроксид аммония 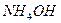
193. Каким процессом является электролитическая диссоциация? обратимой
194. Что принято считать мерой электролитической диссоциации электролита? Степень диссоциации
195. Каким уравнением описывается процесс электролитической диссоциации нитрата бария?
= Ba(NO3)2=Ba^2+=2NO3^-
196. Какое вещество относится к сильным электролитам? KCl
197. При диссоциации какого вещества образуется наибольшее число ионов? Fe2(SO4)3
198. Какой рекции соответствует это сокращенное ионное уравнение? KOH+H2SO4
199. Какая соль при растворении дает нейтральную среду? NaCl
200. Какое краткое ионное уравнение соответствует реакции  ? Cu+2OH=Cu(OH)2
? Cu+2OH=Cu(OH)2
201. Как меняется энергия при растворении гидроксида калия? понижаеться
202. Как называется раствор, в котором при данной температуре данный раствор не растворяется насыщенным
203. При электролизе водного раствора какого вещества на катоде выделяется металл? cульфат Cu(!!)
204. Отметьте схему межмолекулярных окислительно-восстановительных реакций. KMnO4+HCl=KCl+MNCl2+Cl2+???PH2O
205. При электролизе водного раствора какого вещества на катоде выделяется только водород? Хлорид К
206. Для водного раствора какого вещества продукты электролиза те же, что и при электролизе их расплавов? Cu….
207. При электролизе водного раствора какого вещества на катоде выделяется только металл? Металлы стоящие после Н в электро химическом ряду напрежения
208. В случае электролиза водного раствора какого из перечисленных электролитов на катоде выделяется и водород, и металл? После Al до H в электро химическом ряду напрежения
209. Какой процесс протекает на катоде при электролизе водного раствора сульфата калия? Выделяеться водород Н
210. Какое из веществ дает одинаковые продукты при электролизе водного раствора и расплава? CuCl2
211. При электролизе водного раствора сульфата меди с инертным анодом образуются следующие продукты: На катоде Cu на аноде O2
212. Чему равна степень диссоциации электролита, если из 150 молекул распались на ионы 90? 60
213. Укажите, какая пара ионов может находиться одновременно в растворе. Калций хлорид
214. Какое краткое ионное уравнение соответствует реакции взаимодействия гидроксида железа(III) с азотной кислотой? Fe(Oh)3 + 3H= H2O+ Fe
215. В растворе какой соли рН < 7? Cu(NO3)2
216. Какая из приведенных реакций идет в растворе до конца? H2SO4
217. Укажите реакцию среды в растворе сульфата меди (II). Кислая рН < 7
218. В растворе какой соли рН > 7? Na2CO3
219. Какое вещество является в растворе сильным электролитом ..SO4. ,..Cl, …NO3
220. Какой рекции соответствует это сокращенное ионное уравнение  ? Сульфид натрия
? Сульфид натрия