Стандартные энтропии некоторых веществ.
ПРАВИЛО ФАЗ ГИББСА в термодинамике: число равновесно сосуществующих в какой-либо системе фаз не может быть больше числа образующих эти фазы компонентов плюс, как правило, 2. Установлено Дж. У. Гиббсом в 1873-76.
ГИББСА ЭНЕРГИЯ (изобарно-изотермический потенциал, свободная энтальпия), один из потенциалов термодинамических системы. Обозначается G, определяется разностью между энтальпией H и произведением энтропии S на термодинамическую температуру Т: G = H -- T·S. Изотермический равновесный процесс без затраты внешних сил может протекать самопроизвольно только в направлении убывания энергии Гиббса до достижения ее минимума, которому отвечает термодинамическое равновесное состояние системы. Названа по имени Дж. У. Гиббса.
6. Скорость химической реакции - это изменение концентрации реагирующих веществ в единицу времени.
При гомогенных реакциях пространством реакции обозначается объем реакционного сосуда, а при гетерогенных - поверхность, на которой протекает реакция. Концентрацию реагирующих веществ обычно выражают в моль/л - количестве молей вещества в 1 литре раствора.
Зависимость скорости реакций от концентрации
При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает в соответствии с кинетическим уравнением.
Рассмотрим общее уравнение реакции: aA +bB = cC + dD. Для данной реакции кинетическое уравнение принимает вид:
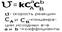
Скорость химической реакции зависит от природы реагирующих веществ, концентрации, температуры, давления, поверхности соприкосновения веществ и ее характера, присутствия катализаторов.
Увеличение концентрации веществ, вступающих в химическое взаимодействие, приводит к увеличению скорости химической реакции. Это происходит потому, что все химические реакции проходят между некоторым количеством реагирующих частицами (атомами, молекулами, ионами). Чем больше этих частичек в объеме реакционного пространства, тем чаще они соударяются и происходит химическое взаимодействие. Химическая реакция может протекать через один или несколько элементарных актов (соударений). На основании уравнения реакции можно записать выражение зависимости скорости реакции от концентрации реагирующих веществ.
Константа скорости реакции - удельная скорость реакции - является коэффициентом пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
Закон действующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии. Закон действующих масс сформулирован в 1864—1867 гг. К. Гульдбергом и П. Вааге. Согласно этому закону скорость, с которой вещества реагируют друг с другом, зависит от их концентрации. Закон действующих масс используют при различных расчетах химических процессов. Он позволяет решить вопрос, в каком направлении возможно самопроизвольное течение рассматриваемой реакции при заданном соотношении концентраций реагирующих веществ, какой выход нужного продукта может быть получен.
Общая формула
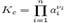 где, ai — активности веществ, выраженные через концентрации, парциальные давления либо мольные доли;
где, ai — активности веществ, выраженные через концентрации, парциальные давления либо мольные доли;
νi — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным);
Kc — константа химического равновесия
7. Зависимость скорости реакций от температуры Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией - активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно, химические реакции при высоких температурах протекают быстрее, чем при низких температурах. Зависимость скорости реакции от температуры определяется правилом Вант - Гоффа:

Правило Вант - Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
Катализаторы - это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождается в конце реакции.
Энергия активации
Сильное изменение скорости реакции с изменением температуры объясняется тем, что в химическое взаимодействие вступают только активные молекулы (частицы), обладающие энергией, достаточной для осуществления данной реакции. Неактивные частицы можно сделать активными, если сообщить им необходимую дополнительную энергию, — этот процесс называется активацией.
8. Хими́ческое равнове́сие — состояние химической системы, при котором возможны реакции, идущие с равными скоростями в противоположных направлениях. При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем.
КОНСТАНТА РАВНОВЕСИЯ (от лат. constans, род. падеж constantis - постоянный, неизменный), величина, определяющая для данной хим. р-ции соотношение между термодинамич. активностями исходных в-в и продуктов в состоянии хим. равновесия.
КОНСТАНТА РАВНОВЕСИЯ связана со стандартным изменением энергии Гиббса DG° рассматриваемой р-ции при данных т-ре Т и давлении р соотношением: RTlnKa=-DG° (R-газовая постоянная). Зависимости Ка от т-ры и давления выражаются соотношениями:

где DH° и DV° - соотв. стандартные изменения энтальпии и объема системы при данной р-ции.
9. Перевод равновесной химической системы из одного состояния равновесия в другое называется смещением (сдвигом) химического равновесия, которое осуществляется изменением термодинамических параметров системы - температуры, концентрации, давления При смещении равновесия в прямом направлении достигается увеличение выхода продуктов, а при смещении в обратном направлении - уменьшение степени превращения реагента. И то, и другое может оказаться полезным в химической технологии.
Направление сдвига химического равновесия определяется принципом Ле-Шателье : если на систему в состоянии истинного равновесия воздействовать извне, изменяя термодинамические параметры, то равновесие сместится в том направлении, которое ослабит эффект внешнего воздействия.
Влияние температуры на состояние равновесия различно для эндотермических (DН° > 0) и экзотермических (DН°< 0) реакций. В соответствии с принципом Ле-Шателье изменение температуры смещает направление этих реакций (показано стрелкой), тем самым уменьшая эффект внешнего воздействия на систему:
повышение температуры А D В; DН° > 0 (®)
(нагревание) В D А; DН° < 0 ()
понижение температуры А D В; DН° > 0 ()
(охлаждение) В D А; DН° < 0 (®)
Например, смещение равновесия в реакции
СО2(г) + Н2(г) D СО(г) + Н2О(г); DН° = + 41 кДж
При повышении температуры будет осуществляться в прямом так как реакция эндотермическая), а при понижении температуры - в обратном направлении. Этот фактор смещения равновесия применим ко всем химическим системам вне зависимости от агрегатного состояния реагентов и продуктов.
Влияние концентрации на состояние равновесия ограничено изменением содержания только тех веществ, равновесные концентрации которых входят в выражение для константы равновесия.
Для гомогенных реакций (5.1) в соответствии с принципом Ле-Шателье введение избытка одного из реагентов вызовет смещение равновесия в прямом, а введение избытка одного из продуктов - в обратном направлении, тем самым ослабляя эффект внешнего воздействия на систему:
избыток реагента (А или В) (®)
избыток продукта (С или D) ()
Для гетерогенных реакций введение дополнительного количества жидкого или твердого вещества (реагента или продукта) не влияет на состояние равновесия. Например, для гетерогенной реакции
Cu2O(т) + 2 HCl(г) D 2 CuCl(ж) + H2O(г)
Добавление в систему избытка хлороводорода сместит равновесие в прямом направлении, а ввдение избытка твердого оксида меди(I) на состояние равновесия не повлияет.
Влияние давления на состояние равновесия проявляется только при наличии в системе газов. В соответствии с принципом Ле-Шателье увеличения давления смещает равновесие в сторону той (прямой или обратной) реакции, которая сопровождается уменьшением объема (газообразных продуктов или реагентов соответственно). А уменьшение давления - в противоположную сторону. Поскольку объем газообразных реагентов и продуктов пропорционален сумме их стехиометрических коэффициентов (обозначенной ånреаг. и ånпрод.), то изменение давления в гомогенных реакциях (5.1) сместит равновесие в следующем направлении, тем самым уменьшая эффект внешнего воздействия на систему:
увеличение ånреаг > ånпрод (®)
давления ånреаг < ånпрод ()
уменьшение ånреаг > ånпрод ()
давления ånреаг < ånпрод (®)
10. Растворение веществ сопровождается тепловым эффектом: выделением или поглощением теплоты - в зависимости от природы вещества. При растворении в воде, например, гидроксида калия, серной кислоты наблюдается сильное разогревание раствора, т.е. выделение теплоты, а при растворении нитрата аммония - сильное охлаждение раствора, т.е. поглощение теплоты. В первом случае осуществляется экзотермический процесс (∆H < 0), во втором - эндотермический (∆H > 0). Теплота растворения ∆H - это количество теплоты, выделяющееся или поглощающееся при растворении 1 моль вещества. Так, для гидроксида калия ∆H ° = -55,65 кДж/моль, а для нитрата аммония ∆H ° = +26,48 кДж/моль.
В результате химического взаимодействия растворенного вещества с растворителем образуются соединения, которые называют сольватами (или гидратами, если растворителем является вода). Образование таких соединений роднит растворы с химическими соединениями.
Великий русский химик Д.И. Менделеев создал химическую теорию растворов, которую он обосновал многочисленными экспериментальными данными, изложенными в его книге «Исследования водных растворов по их удельному весу», вышедшей в 1887 г. «Растворы суть химические соединения, определяемые силами, действующими между растворителем и растворенным веществом», - писал он в этой книге. Теперь известна природа этих сил. Сольваты (гидраты) образуются за счет донорно-акцепторного, ион-дипольного взаимодействий, за счет водородных связей, а также дисперсионного взаимодействия (в случае растворов родственных веществ, например бензола и толуола).
Особенно склонны к гидратации (соединению с водой) ионы. Ионы присоединяют полярные молекулы воды, в результате образуются гидратированные ионы; поэтому, например, в растворе ион меди (II) голубой, в безводном сульфате меди он бесцветный. Многие из таких соединений непрочны и легко разлагаются при выделении их в свободном виде, однако в ряде случаев образуются прочные соединения, которые можно легко выделить из раствора кристаллизацией. При этом выпадают кристаллы, содержащие молекулы воды.
Кристаллические вещества, содержащие молекулы воды, называютя кристаллогидратами, а вода, входящая в состав кристаллогидратов, называется кристаллизационной. Кристаллогидратами являются многие природные минералы. Ряд веществ (в том числе и органические) получаются в чистом виде только в форме кристаллогидратов. Д.И. Менделеев доказал существование гидратов серной кислоты, а также ряда других веществ.
Таким образом, растворение - не только физический, но и химический процесс. Растворы образуются путем взаимодействия частиц растворенного вещества с частицами растворителя. Ученик Д.И. Менделеева Д.П. Коновалов всегда подчеркивал, что между химическими соединениями и растворами нет границ.
Жидкие растворы занимают промежуточное положение между химическими соединениями постоянного состава и механическими смесями. Как и химические соединения, они однородны и характеризуются тепловыми явлениями, а также часто наблюдающейся концентрацией - сокращением объема при смешивании жидкостей. С другой стороны, в отличие от химических соединений растворы не подчиняются закону постоянства состава. Они, как и смеси, могут быть легко разделены на составные части. Процесс растворения есть физико-химический процесс, а растворы - физико-химические системы.
Сольватация (от лат. solvo — растворяю) — электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества и растворителя
Гидратация (от греч. hydor — вода) — присоединение молекул воды к молекулам или ионам.
11. Растворимость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе.
Ненасыщенный раствор — раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое его количество.
Перенасыщенные растворы - растворы, характеризующиеся тем, что содержание в них растворенного вещества больше соответствующего его нормальной растворимости при данных условиях.
В отсутствие химического взаимодействия газы смешиваются друг с другом в любых пропорциях, и в этом случае говорить о насыщении нет смысла. Однако при растворении газа в жидкости существует некая предельная концентрация, зависящая от давления и температуры. Растворимость газов в некоторых жидкостях коррелирует с их способностью к сжижению. Наиболее легко сжижаемые газы, например NH3, HCl, SO2, более растворимы, чем трудно сжижаемые газы, например O2, H2 и He. При наличии химического взаимодействия между растворителем и газом (например, между водой и NH3 или HCl) растворимость увеличивается. Растворимость данного газа изменяется с природой растворителя, однако порядок, в котором располагаются газы в соответствии с увеличением их растворимости, остается примерно одинаковым для разных растворителей.
Зако́н Ге́нри — закон, по которому при постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Закон пригоден лишь для идеальных растворов и невысоких давлений.
Закон Генри записывается обычно следущим образом:
 ,где р - парциальное давление газа над раствором,
,где р - парциальное давление газа над раствором,
с - концентрация газа в растворе в долях моля,
к - коэффициент Генри.
Экстракция (от позднелат. extractio — извлечение), экстрагирование, процесс разделения смеси жидких или твёрдых веществ с помощью избирательных (селективных) растворителей (экстрагентов)
12. Массовая доля это отношение массы растворенного вещества к общей массе раствора. Для бинарного раствора
ω(x) = m(x) / (m(x) + m(s)) = m(x) / m
где ω(х) - массовая доля растворенного вещества Х
m(x) - масса растворенного вещества Х, г;
m(s) - масса растворителя S, г;
m = m(x) + m(s) - масса раствора, г.
Массовую долю выражают в долях единицы или в процентах (например - ω = 0,05 или 5%)
Молярная концентрация — число молей растворённого вещества в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м3, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности».
Нормальная концентрация - показывает число эквивалентов растворенного вещества в 1 литре раствора.
13.РАСТВОРЫНЕЭЛЕКТРОЛИТОВ, бинарные или многокомпонентные мол. системы, состав к-рых может изменяться непрерывным образом (по крайней мере, в нек-рых пределах). В отличие от растворов электролитов, в растворы неэлектролитов (мол. р-рах) заряженные частицы в сколько-нибудь заметных концентрациях отсутствуют. растворы неэлектролитов могут быть твердыми, жидкими и газообразными.
Первый закон Рауля
Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.

Второй закон Рауля
Тот факт, что давление паров над раствором отличается от давления паров над чистым растворителем, существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля.
Криоскопия (от греч. kryos — холод и scopeo — смотрю) — измерение понижения температуры замерзания раствора по сравнению с чистым растворителем. Метод криоскопии, предложенный в 1882 г. Ф. Раулем, применяют для определения молекулярной массы растворенного вещества. При этом берут соответствующее количество чистого растворителя и измеряют его температуру замерзания. Затем вновь расплавляют растворитель, вносят в него навеску изучаемого вещества и измеряют температуру начала замерзания полученного раствора при помощи того же термометра. Понижение температуры замерзания предельно разбавленного раствора прямо пропорционально его моляльной концентрации (закон Рауля).
Эбулиоскопия (от лат. ebulio — вскипаю) — измерение повышения температуры кипения раствора по сравнению с чистым растворителем для определения молекулярной массы растворенного вещества. Основано на законе Рауля.
Осмос (от греч. ὄσμος «толчок, давление») — процесс диффузии растворителя из менее концентрированного раствора в более концентрированный.
Осмотическое давление — сила, действующая на полупроницаемую мембрану, разделяющую два раствора с разной концентрацией растворенных веществ и направленная от более разбавленного к более концентрированному раствору. Осмотическое давление может быть очень значительным. Величина осмотического давления, создаваемая раствором, зависит от количества, а не от химической природы растворенных в нём веществ (или ионов, если молекулы вещества диссоциируют) Закон осмотического давления можно использовать для расчета молекулярной массы данного вещества. Pосм=m/M*RT
Вант-Гоффа закон: осмотического давления, определяет давление молекул растворённого вещества на полупроницаемую перепонку, отделяющую раствор от чистого растворителя и непроницаемую для растворённого вещества.
14. РАСТВОРЫЭЛЕКТРОЛИТОВ, содержат в заметных концентрациях ионы-катионы и анионы, образующиеся в результате электролитической диссоциации молекул растворенного в-ва.
Сильные электролиты - химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы.
Слабые электролиты - химические соединения, молекулы которых даже в сильно разбавленных растворах не полностью диссоциированы на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами.
Закон разведения Освальда.
Если первоначальная концентрация электролита C0, а степень диссоциации то
Kд= C02/1-
Для слабых электролитов: 1-
Kд C02
 Kд/ C0)
Kд/ C0)
15. Электролитическая диссоциация — распад вещества на ионы под действием полярных молекул растворителя или при расплавлении.
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH−
или
H2O ↔ H+ + OH−
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:

где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Водородный показатель (рН) - параметр, характеризующий концентрацию водородных ионов в растворе, т. е. степень его щелочности или кислотности. Показатель рН может изменяться от 0 до 14. Раствор, в котором рН равно семи, является нейтральным, ниже семи - кислым, выше - щелочным.
Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NН3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щелочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях. Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
16. РЕАКЦИИ В РАСТВОРАХ, хим. р-ции, идущие между растворенными в-вами, а также между растворенным в-вом и р-рителем. Как правило, р-ритель принимает непосредств. участие в хим. взаимодействии. С одной стороны, р-ритель проявляет себя как сплошная среда (континуум), характеризующаяся вязкостью, диэлектрич. проницаемостью, поляризацией и т. п.; с другой стороны-как совокупность молекул, обладающих размером, дипольным моментом, поляризуемостью и участвующих в межмолекулярном взаимодействии друг с другом и с молекулами растворенного в-ва, к-рое м. б. описано соответствующими потенциалами. Молекулы р-ри-теля образуют упорядоченные структуры на расстояниях, сравнимых с межмолекулярными (ближний порядок), что отражается видом корреляц. ф-ции распределения (см. Жидкость).