Номенклатура
Название кислот образуется так, что к названию предельного углеводорода прибавляется -овая кислота.
| Формула алкана | Название алкана | Формула кислоты | Название кислоты |
| СН4 | метан | НСООН | метановая кислота (муравьиная) |
| С2Н6 | этан | СН3СООН | этановая кислота (уксусная) |
| С3Н8 | пропан | С2Н5СООН | пропановая кислота (пропионовая |
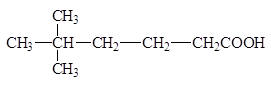
5,5-диметил гексан овая кислота
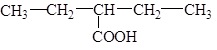
2-этил бутан овая кислота
пентан-3-карбоновая кислота
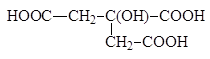
3-карбокси-3-гидроксипентандиовая-1,5 кислота (лимонная)
Тривиальные названия важнейших кислот
Алифатические предельные одноосновные кислоты:
| НСООН | муравьиная |
| СН3СООН | уксусная |
| С2Н5СООН | пропионовая |
| С3Н7СООН | масляная |
| С5Н11СООН | валериановая |
| С6Н13СООН | капроновая |
| С15Н31СООН | пальмитиновая |
| С17Н35СООН | стеариновая |
Непредельные кислоты:
| СН2=СН-СООН | акриловая |
| СН3-(СН2)7-СН=СН-(СН2)7-СООН | олеиновая |
Ароматические кислоты:
| С6Н5COOH | бензойная |
Двухосновные кислоты:
| НООС-СООН | щавелевая |
| НООС-СН2-СООН | малоновая |
Смотрим видео 2: https://www.youtube.com/watch?v=-KZy6ahS3Oo
Записываем:
Кислотные свойства – способность к отщеплению иона водорода.
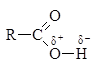 ⇆
⇆ 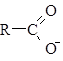 +H+
+H+
В чем проявляются кислотные свойства карбоновых кислот?
1. Наличие свободного иона водорода в растворах кислот обуславливает их кислый вкус и взаимодействие с индикаторами.

2. Кислоты взаимодействуют с активными металлами, выделяя водород:
2СН3СOOH + Mg → (СН3СOO)2Mg + H2
этанат магния
(ацетат магния)
3. Реакции c основаниями:
СН3СOOH + NaOH → СН3СOONa + H2O.
4. Реакции с основными оксидами:
2СН3СOOH + ZnO → (СН3СOO)2Zn + H2O.
5. Реакции с солями более слабых кислот:
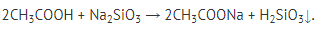
Электролит – вещество, диссоциирующее на ионы в растворе или расплаве.
Сильный электролит – электролит, диссоциирующий на ионы полностью.
Слабый электролит – электролит, диссоциирующий на ионы частично.
Карбоновые кислоты → слабые электролиты:
СН3СООН  СН3СОО- + Н+
СН3СОО- + Н+
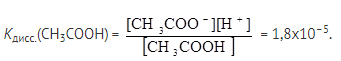
От чего зависит сила карбоновой кислоты?
1. От строения
Чем больше положительный заряд на атоме водорода в молекуле кислоты, тем более сильным электролитом она будет. Наличие электронодонорных углеводородных радикалов рядом с карбоксильной группой уменьшает способность кислоты диссоциировать.
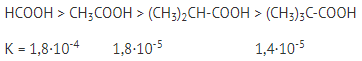
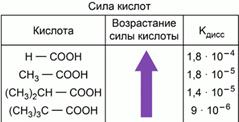
2. От наличия других групп в молекуле
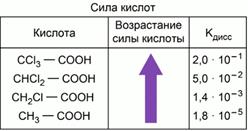
Введение электроноакцепторных заместителей увеличивает положительный заряд на атоме водорода и силу кислоты.
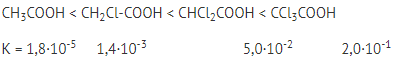
| Пропионовая | СН3-СН2-СООН | К = 1,3·10-5 |
| Молочная | СН3-СНОН-СООН | К = 1,5·10-4 |
| Муравьиная | НСООН | К = 1,8·10-4 |
| Щавелевая | НООС-СООН | К1 = 5,6·10-2 |
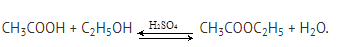
Нуклеофильное замещение (реакция этерификации)
Карбоновые кислоты взаимодействуют со спиртами в присутствии катализатора – серной кислоты, образуя сложные эфиры.
Декарбоксилирование – удаление карбоксильной группы.
1. При нагревании с твердыми щелочами соли карбоновых кислот дают алкан с числом атомов углерода на единицу меньше, а карбоксильная группа удаляется в виде карбоната:
RCOONaтв + NaOHтв 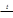 RH + Na2CO3.
RH + Na2CO3.
2. Твердые соли карбоновых кислот со щелочноземельными металлами при нагревании дают кетон и карбонат:
(СН3СОО)2Са 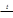 СН3-СО-СН3 + СаСО3.
СН3-СО-СН3 + СаСО3.
3. Бензойная кислота при прокаливании разлагается на бензол и углекислый газ:
Ph-COOH 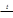 PhH + CO2.
PhH + CO2.
4. При электролизе водных растворов солей карбоновых кислот на аноде выделяется углекислый газ, а углеводородные радикалы объединяются в алкан (реакция Кольбе):
2RCOONa + Н2О → R-R + 2CO2 + 2NaOH.
При электролизе без диафрагмы (с неразделенным катодным и анодным пространством) гидроксид натрия взаимодействует с углекислым газом, и одним из продуктов является гидрокарбонат:
2RCOONa + Н2О → R-R + 2NaHCO3.
Домашнее задание: совершить цепочку превращений
Метан – хлорметан – этан – хлорэтан – этиловый спирт – уксусный альдегид – уксусная кислота – пропиловый эфир уксусной кислоты