Материаловедение. Занятие №2.
В зависимости от расположения атомов в пространстве различают материалы с кристаллической и аморфной структурой. Кристаллическое состояние характеризуется большей устойчивостью, чем аморфное, материалы с аморфной структурой со временем могут переходить в кристаллическое состояние.
Кристаллические тела характеризуются упорядоченным расположением атомов, ионов, молекул в пространстве в отличие от аморфных, имеющих хаотическое расположение атомов. Кристаллическое строение можно представить себе в виде пространственной решетки, в узлах которой расположены атомы, ионы, молекулы.
Стремление атомов расположиться возможно ближе друг к другу приводит к тому, что число встречающихся комбинаций взаимного расположения атомов в металлических материалах невелико. Расположение атомов удобно изображать в виде элементарных кристаллических ячеек. Элементарная кристаллическая ячейка — наименьшее число атомов, которое при многократном повторении в пространстве позволяет построить пространственную кристаллическую структуру.
Большинство металлов и сплавов образует одну из следующих высокосимметричных решеток с плотной упаковкой атомов: кубическую объемно-центрированную, кубическую гранецентрированную, тетрагональную, гексагональную (рис.1)
Кубическую объемно-центрированную (ОЦК) решетку имеет aFe — кристаллическая модификация железа до 910 °С. Такую же решетку имеют Cr, Mo, W, V, pTi. Параметры решетки (расстояние между центрами ближайших атомов в элементарной ячейке): а = Ь = с, а = 0,1—0,5 нм. Кубическая гранецентрированная (ГЦК) решетка характерна для YFe-кристаллической модификации железа, существует при температуре выше 910 °С. Решетку ГЦК имеют Ni, Mn, Си, А1 и другие металлы. Параметры решетки: а = b = с, а = 0,1—0,7 нм.
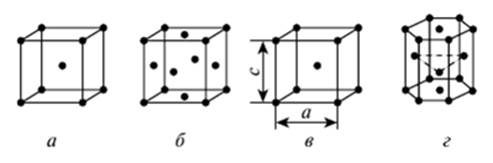
Рнс. 1. Кристаллические решетки металлов: а — кубическая объемноцентрированная (ОЦК); б — кубическая гранецентрированная (ГЦК); в — тетрагональная; г— гексагональная плотноупакованная (ГПУ)
Тетрагональную решетку имеет сталь после термической обработки закалки; параметры решетки: а = Ь*с, с/а > 1. Отношение параметров с/а характеризует степень тетрагональное™ решетки.
Ячейка гексагональной плотноупакованной (ГПУ) решетки — прямая призма, в основании которой находится правильный шестиугольник. Три атома находятся внутри ячейки по высоте на половине параметра с, с*- а. Такую решетку имеют Mg, aTi, Zn и др.
Кристаллическая решетка помимо параметров решетки характеризуется атомной плотностью.
Атомная плотность — количество атомов, приходящихся на одну ячейку. Атом в вершине кубической объемно-центрированной ячейки принадлежит одновременно восьми ячейкам, примыкающим к этой вершине, следовательно, на долю одной ячейки приходится 1/8 часть атома, в центре каждой ячейки находится 1 атом, полностью принадлежащий этой ячейке; атомная плотность решетки ОЦК составляет: «оцк = 1/8 • 8 + 1 = 2 атома на ячейку, атомная плотность решеток ГЦК и ГПУ составляет соответственно: лгцк = 1/8 • 8 + 1/2 -6 = 4 ат/яч, «гпу = 3 + 1/6 • 12 + 1/2 • 2 = 6 ат/яч.
Кроме числа атомов, приходящихся на элементарную ячейку, кристаллическое строение характеризует координационное число.
Число ближайших равноудаленных элементарных атомов определяет координационное число: для ОЦК — К8, для ГЦК — К12. Чем выше координационное число, тем больше плотность упаковки атомов. Для определения положения атомных плоскостей в пространстве пользуются индексами А, к, /, являющимися целыми рациональными величинами, обратными отрезкам осей, отсекаемым атомными плоскостями на осях координат (рис. 2.2, а).
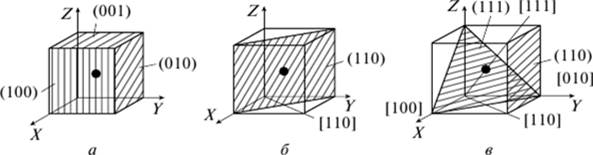
Рнс. 2.Индексы кристаллографических плоскостей и направлений: а — индексы плоскостей; б, в — индексы плоскостей и перпендикулярных к ним направлений
Индексы плоскостей заключают в круглые скобки и не разделяют запятыми: (100), (010), (111).
Для определения индексов направлений расположения рядов атомов в кристаллической решетке необходимо в направлении плоскости, проходящей через начало координат, выбрать координаты любой точки направления (рис. 2.2, б, в). Индексы направлений заключают в квадратные скобки. Индексы направлений для кубической решетки [uvw, перпендикулярных к плоскости (hkl), численно равны индексам этой плоскости.
Пластичность металла существенно зависит от типа кристаллической решетки. Внутри кристалла пластическая деформация происходит в основном путем скольжения одних слоев металла относительно других по определенным кристаллографическим плоскостям, которые называются плоскостями скольжения. Обычно плоскостями скольжения являются плоскости с наиболее плотным размещением атомов,
Наиболее пластичны металлы с гранецентрированной решеткой, с объемно-центрированной — менее пластичны, еще меньшую пластичность имеют металлы с гексагональной решеткой. Это определяется количеством кристаллографических плоскостей и их направлений, по которым происходит скольжение металла при пластической деформации.
Твердые тела (кристаллы) характеризуются наличием значительных сил межмолекулярного взаимодействия и сохраняют постоянными не только свой объем, но и форму. Кристаллы имеют правильную геометрическую форму, которая является результатом упорядоченного расположения частиц (атомов, молекул, ионов), составляющих кристалл. Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в трех измерениях, называется кристаллической решеткой. Точки, в которых расположены частицы, а точнее — точки, относительно которых частицы совершают колебания, называются узлами кристаллической решетки.
Кристаллические тела можно разделить на две группы: монокристаллы и поликристаллы. Монокристаллы — твердые тела, частицы которых образуют единую кристаллическую решетку. Кристаллическая структура монокристаллов обнаруживается по их внешней форме. Хотя внешняя форма монокристаллов одного вида может быть различной, но углы между соответствующими гранями у них остаются постоянными. Это закон постоянства углов, сформулированный М.В.Ломоносовым. Он сделал важный вывод, что правильная форма кристаллов связана с закономерным размещением частиц, образующих кристалл. Монокристаллами являются большинство минералов. Однако крупные природные монокристаллы встречаются довольно редко (например, лед, поваренная соль, исландский шпат). В настоящее время многие монокристаллы выращиваются искусственно. Условия роста крупных монокристаллов (чистый раствор, медленное охлаждение и т. д.) часто не выдерживаются, поэтому большинство твердых тел имеет мелкокристаллическую структуру, т. е. состоит из множества беспорядочно ориентированных мелких кристаллических зерен. Такие твердые тела называются поликристаллами (многие горные породы, металлы и сплавы).
Характерной особенностью монокристаллов является их анизотропность, т. е. зависимость физических свойств —упругих, механических, тепловых, электрических, магнитных, оптических — от направления. Анизотропия монокристаллов объясняется тем, что в кристаллической решетке различно число частиц, приходящихся на одинаковые по длине, но разные по направлению отрезки (рис. 102), т. е. плотность расположения частиц кристаллической решетки по разным направлениям не одинакова, что и приводит к различию свойств кристалла вдоль этих направлений. В поликристаллах анизотропия наблюдается только для отдельных мелких кристалликов, но их различная 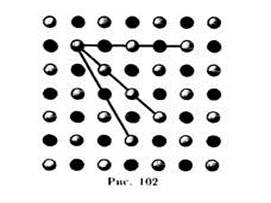 ориентация приводит к тому, что свойства поликристалла по всем направлениям в среднем одинаковы.
ориентация приводит к тому, что свойства поликристалла по всем направлениям в среднем одинаковы.
2. Типы кристаллических твердых тел
Существует два признака для классификации кристаллов: 1) кристаллографический; 2) физический
I. Кристаллографический признак кристаллов. В данном случае важна только пространственная периодичность в расположении частиц, поэтому можно отвлечься от их внутренней структуры, рас сматривая частицы как геометрические точки.
Кристаллическая решетка может обладать различными видами симметрии. Симметрия кристаллической решетки — ее свойствосовмещаться с собой при некоторых пространственных перемещениях, например параллельных переносах, поворотах, отражениях или их комбинациях и т.д. Всякая пространственная решетка может быть составлена повторением в трех различных направлениях одного и того же структурного элемента — элементарной ячейки. Всего существует 14 типов решеток Бравэ, различающихся по виду переносной симметрии. Они распределяются по семи кристаллографическим системам, или сингониям, представленным в порядке возрастающей симметрии в табл. 3. Для описания элементарых ячеек пользуются кристаллографическими осями координат, которые проводят параллельно ребрам элементарной ячейки, а начало координат выбирают в левом углу передней грани элементарной ячейки. Элементарная кристаллическая ячейка представляет собой параллелепипед, построенный на ребрах а, 6, с с углами a, β и γ между ребрами (табл. 3). Величины а, b и с и a, β и γ называются параметрами элементарной ячейки и однозначно ее определяют.
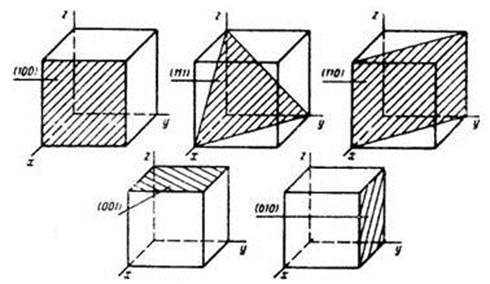
Рис. 3. Основные кристаллографические плоскости кубической решетки

|
Для задания направления в кристалле достаточно задать координаты любого атома тройкой целых чисел, заключенных в скобки (x,y,z). Если плоскость параллельна какой-либо из координатных осей, то индекс, соответствующей этой оси равен нулю. Основные кристаллографические плоскости кубической решетки показаны на рисунке 2.2.
Кристалл кремния (кристалл с кубической решеткой) имеет три кристаллографические плоскости (100, 11О, 111):

Рис. 4. а) — кристаллографические плоскости, 6) — расположение атомов в кристаллографических плоскостях
2. Физический признак кристаллов. В зависимости от рода частиц, расположенных в узлах кристаллической решетки, и характера сил взаимодействия между ними кристаллы разделяются на четыре типа: ионные, атомные, металлические, молекулярные.
Атомные кристаллы. В узлах кристаллической решетки располагаются нейтральные атомы, удерживающиеся в узлах решетки гомеополярными, или ковалентными, связями квантово-механического происхождения (у соседних атомов обобществлены валентные электроны, наименее связанные с атомом). Атомными кристаллами являются алмаз и графит (два раз- личных состояния углерода), некоторые неорганические соединения (ZnS, BeO и т.д.), а также типичные полупроводники — германий Ge и кремний Si. Валентные связи осуществляются парами электронов, движущихся по орбитам, охватывающим оба атома.
Кремний и германий представляют собой кристаллы с регулярной структурой. Кристаллическая решетка кремния и германия называется тетраэдрической или решеткой типа алмаза Основу решетки составляет тетраэдр — пространственная фигура, имеющая четыре треугольные грани. В вершинах тетраэдра и в его центре расположены атомы. Центральный атом находится на одинаковом расстоянии от четырех других, находящихся в вершинах. А каждый атом, расположенный в вершине, в свою очередь, является центральным для других четырех ближайших атомов.
При рассмотрении физических процессов в полупроводниковых материалах удобнее пользоваться плоским эквивалентом тетраэдрической решетки (рис. 5). Все атомы (большие шарики) находятся в парноэлектронной, ковалентной или просто валентной связи. Парноэлектронные связи (линии на рисунке) образуются валентными электронами (на рисунке — маленькие шарики) при сближении атомов. Так располагаются атомы чистых четырехвалентных элементов, в том числе Ge и Si, при очень низкой температуре.

Рис. 5. Плоский эквивалент тетраэдрической решетки.
Задание: 1. Подготовить конспект лекции в печатном word-документе.
2. Предоставить методы получения монокристаллов.
Срок выполнения 22.01.2021.