Строение атома
План
1. Теория атома водорода
1.1. Модели Т омсона и Резерфорда
1.2. Постулаты Бора
1.3. Радиус орбиты, скорость и энергия электрона на стационарной орбите. Формула Бальмера-Ритца
1.4. Схема уровней энергии атома водорода
2. Опыт Франка и Г ерца
3. Ограниченность теории Бора
4. Водородоподобная система в квантовой механике
5. Квантовые числа
6. Спектр атома водорода
7. Спин электрона. Спиновое квантовое число. Полный момент
одноэлектронного атома
Теория атома водорода
Модели Томсона и Резерфорда
После открытия электрона Томсоном в 1897 г. стало ясно, что электроны входят в состав всех атомов, то есть, что атом имеет структуру и не является неделимым.
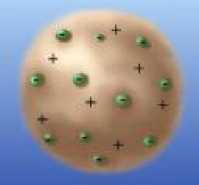
| Рис.22.1 |
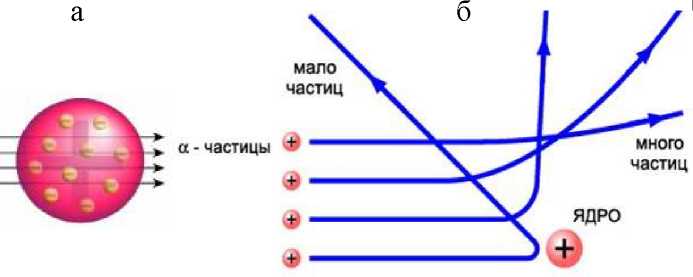
Эта модель не выдержала экспериментальной проверки. В 1911 году Резерфорд исследовал рассеяние альфа-частиц при прохождении через тонкую золотую фольгу (рис.22.2). Использовался источник a-излучения с естественной радиоактивностью, помещённый в контейнер К. С помощью специальных экранов выделялся очень тонкий пучок a-частиц.
Альфа-частица, налетая на фольгу Ф, отклонялась на некоторый угол ф и, попадая на люминесцентный экран, вызывала вспышку. Вспышки можно было наблюдать. Подобные опыты ставились и до Резерфорда, но он первый решил выяснить, не отклоняются ли a-частицы на большие углы - для очистки совести, просто чтобы исключить такую возможность. Модель киселя с изюмом просто не допускала существования в атоме таких плотных и тяжелых элементов структуры, что они могли бы отклонять быстрые массивные альфа-частицы на значительные углы. Резерфорд попросил одного из своих студентов переоборудовать установку таким образом, чтобы можно было наблюдать рассеяние альфа-частиц под большими
| углами отклонения. |
| Рис.22.2 |
непосредственно проводившего эксперимент, но и самого Резерфорда, когда выяснилось, что некоторые частицы отклоняются на углы вплоть до 180°! В рамках устоявшейся модели атома Томсона полученный результат не мог быть истолкован: быстрая и тяжелая альфа-частица «прошила» бы кисель с изюмом насквозь, практически с ним не взаимодействуя (рис.22.3,а). Чтобы отбросить частицу назад, требуется компактное
массивное очень плотное положительно заряженное ядро. Альфа-частицы, пролетающие далеко от ядра, почти не отклоняются. Таких частиц много, так как
 ядромаленькое.Частицы,пролетающиеближекядру, отклоняютсянаб о льший
ядромаленькое.Частицы,пролетающиеближекядру, отклоняютсянаб о льший
| Рис.22.3 |
| Рис.22.5 |
Рис.22.4
угол. И только небольшая доля частиц, летящих почти на ядро, отклоняется на углы, близкие к 180° (рис.22.3,б).
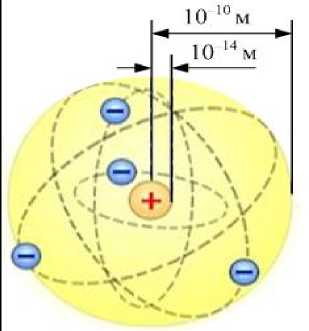
По доле частиц, рассеянных на большие углы, можно оценить размеры ядра: гядра » 10-14 м . Оказалось, что радиус ядра примерно в 10000 раз меньше размеров самого атома: гатома »10-10 м. Б о льшая часть атома - это пустота, занятая очень лёгкими по сравнению с ядром электронами (рис.22.4).
Очевидно, что электроны в атоме не могут быть неподвижными, иначе упадут на положительное ядро. Электроны должны вращаться вокруг ядра, подобно планетам вокруг Солнца. Поэтому ядерная модель Резерфорда получила название «планетарной».
Но опять оказалось не всё так просто; у планетарной модели есть свои трудности и противоречия:
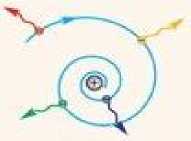
1) Неустойчивость атомов. Электрон движется вокруг ядра, следовательно, имеет центростремительное ускорение. Любая заряженная частица, движущаяся с ускорением, излучает электромагнитные волны. Электрон излучает, поэтому теряет энергию, теряет скорость и падает на ядро (рис.22.5).
2) Спектр излучения атома должен быть сплошным: ничто не мешает
электрону в атоме Резерфорда иметь любую энергию и терять на излучение тоже любую энергию. Однако опыт показывает, что спектры излучения невзаимодействующих атомов (паров металлов, атомарных газов) дискретные, состоят из отдельных спектральных линий.
Для спектра атомарного водорода (рис.22.6) удалось подобрать формулу

| Рис.22.6 |
| длины волн: |
| где |
| - постоянная |
| R =1.T107 м-1 |
| (22.1) |
(формула Бальмера), описывающую
Ридберга; m - целое число, m>2.
| ультрафиолетовой областях спектра спектральные серии, |
| описываемые |
| (22.2) |
У n m 0
где m = n +1; m = n +2; m = n +3;. Если
n =1, получается серия Лаймана (УФ-область);
n =2 - серия Бальмера;
n =3 - серия Пашена;
n =4 - серия Брэккета; L лежат в ИК-области
n =5 - серия Пфунда и т.д.
Для описания спектров Ритц предложил ввести понятие терма: терм (спектральный терм) - функция целого числа (квантового числа): T = f (n). Для
R
атома водорода термы выглядят наиболее просто: T(n) = —. Тогда любую n 2
спектральную линию можно выразить через разность двух термов:
I = T (n)-T (m). (22.3)
l
Для других атомов спектральные термы выглядели несколько сложнее, чем для водорода. Такие правильные закономерности не могли быть случайными, но из планетарной модели атома никак не вытекали. Проблему попытался решить Нильс Бор.
1.2. Постулаты Бора
Постулаты Бора основаны на:
1) экспериментальных закономерностях в атомных спектрах;
2) квантовом характере излучения и поглощения света;
3) ядерной модели атома.
I. Постулат стационарных состояний
Электрон в атоме может находиться только на стационарной орбите; при этом он не излучает и не поглощает энергии. Условие стационарных орбит:
me-о - r = n ■ h; n = 1, 2, 3,...¥. (22.4)
Это - условие квантования: момент импульса электрона Ln на орбите с
| Планка h: |
| Рис.22.7 |
Ln = me ■ о ■ r = p ■ r;
Ln = n ■ h.
Можно интерпретировать условие (22.4) по-другому: устойчивыми орбитами будут те, на длине l = 2p ■ rn которых укладывается целое число длин волн де Бройля ln (рис.22.7):
l _ 2p■rn _me•0■rn _ me - °- rn = n
| ln |
Таким образом, теория Бора учитывает волновые свойства электрона.
II. Правило частот
Энергия излучается или поглощается атомом только при переходе электрона между стационарными орбитами; при этом энергия излучённого или поглощённого кванта равна разности энергий стационарных состояний, между которыми произошёл переход:
hv = Em - En. (22.5)
Это условие - закон сохранения энергии.
1.3. Радиус орбиты, скорость и энергия электрона на стационарной орбите. Формула Бальмера-Ритца
| Рис.22.8 |
| к ядру |
| (22.6) может |
me ' а ц.с. = Fk..
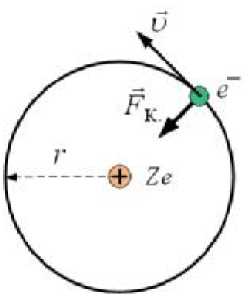
Рассматривается одноэлектронная система; это
быть атом водорода H или водородоподобный ион: однозарядный ион гелия He +, двухзарядный ион лития Li ++ и т.д. (рис.22.8). Пусть Z - зарядовое число ядра, тогда по закону Кулона
| F^=T^. 4р • £0 • r |
| (22.7) |
| С учётом, что а = —, вместе с первым постулатом (22.4) получаем ' r |
| систему уравнений: |
| те |
| и 2 • -- |
| те |
| Z • е r 4p • £0 •r 2 |
| Z • е 2 --------- = те - и 4р •£0 • г п • h r =------ те • и |
| (22.8) |
| Потенциальная и кинетическая энергии электрона равны соответственно: Z • е 2 4 р • £ 0 • r ’ = т^^. |
| E пот. |
| E кин. |
| (22.9) |
| (22.10) |
| Тогда первое уравнение системы (22.8) даёт соотношение между этими энергиями: |
| E— 2 Е кин. = - Е пот., Е кин. = 2. Полная энергия электрона Еп на п -орбите равна сумме кинетической и потенциальной: |
| (22.11) |
| E п Е кин. + Е пот. и может быть выражена или только через кинетическую: = -E кин., |
| Еп = -2 Е кин. + Е кин. или только через потенциальную: Е_. _ пот. + E 2 пот. подставим |
| Теперь вернёмся к (22.8) и первое: |
| те - и 2 |
| 4р • £0 • |
| (22.11а) |
| E пот. второе выражение этой системы в |
| (22.116) |
| те - и 2 |
| те - и 2 |
| 4р • £0 • |
| 2£0 • |
| V2p • те •и0 2 Z • е • т • и те - и =---------- е— 2 £ 0 • п • h |
| _ Z • е П = 7 2 £ 0 • п • h |
| (22.12) |
Выражение для скорости электрона на n -орбите получено. Теперь найдём
радиус орбиты. Из (22.8):
| V 2 Z • e 4p •Eq • r |
| = me -u 2 |
| n • h u = me • r |
| / * X 2 n • h ------; У me • r J |
| r = |
| 4 P 2 У4 p 0 7 2 me • Z • e |
| 4 p • Eq |
| n 2 |
| 2 2 *2 Z • e _ n • h4 p • eq •r e mj.r 2 |
| Z • e 4p • Eq • r |
| = me |
| (22.13) |
| (22.14) |
| и первого постулата, или из (22.12): |
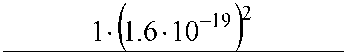
| U 1 2 • 8.85 • 1Q-12 • 1 • 6.625 •Ю-34 Полная энергия по (22.11а) или (22.11 б): .2 А2 -^ •^ У 2 e q • n • h J |
| me • u 2 h^ =----- e---- n кин. 2 |
| me • |
| = 2.2 •IQ" м с |
| me ■ Z 2 • e 4 8 e q • h 2 |
| (22.15) |
n • h • eq
rn = 20
me • Z • e p
Радиус первой Боровский орбиты (Z =1, n =1):
12 •(".625 •1Q-34 К8.85 4Q-12 in_ii
aQ ° r1 = --- *-------- —L у = 5.3 4Q м = 53 пм;
а для любой орбиты:
а о • n
rn =
Скорость электрона на первой Боровский орбите можно найти или из (22.14)
(22.15а)
| Eq = |
| (22.16) |
| 4 me • e 8 e q2 • h 2 |
| = 2.17 • 1Q-18 Дж = 13.6 эВ. |
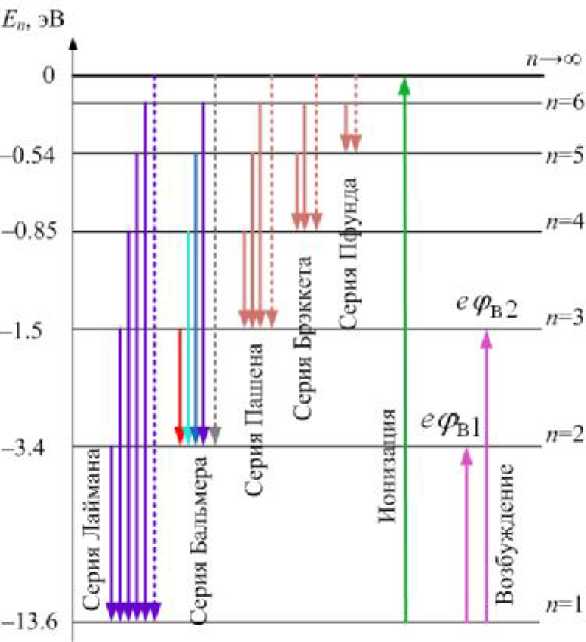
1.4. Схема уровней энергии атома водорода
Схема уровней энергии дана на рис.22.9. Уровни энергии сбегаются кверху; расстояние между ними уменьшается. Энергия электрона в атоме отрицательна (электрон связан с ядром). При n^n энергия равна нулю; это - ионизированное состояние атома, когда электрон не связан с ядром. Уровень с n =1 и минимальной
| энергией соответствует основному состоянию. Остальные состояния (n =2, и =3,...) называются возбуждёнными. По второму постулату Бора можно определить частоту или длину волны фотона, излучённого или поглощённого атомом при переходе электрона между орбитами с номерами n и m (n < m): |
| hn = Em - En ^ |
| hn = |
| f4 8 e o • h у n |
| 2 me • e hn = Z —e— |
| hC = Z 2 - m •e 1 |
| '_ me • Z1 •e 4 У 8 e 02 • h 2 4 Г 1 1 2 ™ 2 m 0 |
| Рис.22.9 |
|
8 e o • h у n
1 = Z 2 •^Г
1 8e2 • nc У n
Обозначим
R = |
| 1 = Z 2 • R • Возможна также другая запись; для частоты спектральных линий (22.2б). '4 _J2 У (22-2б> у n 2 m 2 0 |
| n = Z 2 • R'- |
| Здесь постоянная Ридберга равна:
R= |
| • 3 • 108 = 3.3 • 1015 - с |
| спектральным сериям. Пунктиром указаны переходы, соответствующие границам серий. Головная линия серии соответствует переходу с ближайшего уровня. При излучении фотона электрон переходит на уровень с меньшей энергией (стрелки вниз); при поглощении фотона электрон переходит на более высокий уровень. Энергия ионизации атома равна разности энергий основного состояния и |
| ионизированного: |
| Анод |
| Рис.22.10 |
 2 ~4
2 ~4
Еи = Е „- Е1 = Е 1| = e • 2 2.
8 e t2 • h 2
Можно выразить по-другому из (22.15)-(22.17): Еи = Rhc • Z 2.
Если ионизация происходит не из основного состояния, а из возбуждённого с номером n, тогда
Rhc • Z 2
E = --------------------
и 2 ■
n
Найдём потенциал ионизации атома. По определению, потенциал ионизации - это разность потенциалов, которую должен пройти электрон в электрическом поле, чтобы получить энергию, равную энергии ионизации атома:
Еи
Ри ■
e
Потенциал ионизации атома водорода из основного состояния равен 13.6 эВ.
Первый потенциал возбуждения соответствует переходу из основного состояния в первое возбуждённое (n =1 ^ n =2) и равен рв1 = ———; второй потенциал возбуждения - переходу с основного уровня на второй возбуждённый Е - Е
(n =1^ n =3) и т.д. (см. рис.22.9): рв 2 = —----- к
e
2. Опыт Франка и Герца
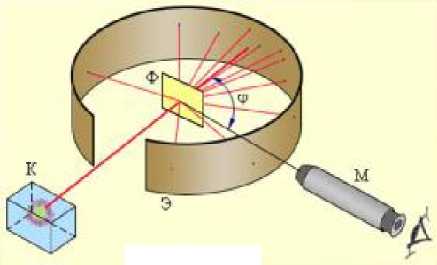
Подтверждением теории Бора и принципа квантования энергии атома был опыт Франка и Герца (1913 год). Главная часть установки (рис.22.10) - это
вакуумированный сосуд с тремя
электродами, содержащий пары ртути под низким давлением (около 1 мм рт.ст.). Катод нагревают электрическим током, и в результате термоэлектронной эмиссии он испускает электроны. Электроны ускоряются напряжением U, созданным между катодом и сеткой. Напряжение можно менять потенциометром П. Анодный ток регистрируется амперметром. Между сеткой и анодом создано небольшое (порядка 0.5 В) задерживающее напряжение.
При увеличении напряжения ток сначала монотонно увеличивается, но при U =4.9 В и кратных ему напряжениях (9.8 В; 14.7 В,...) на вольтамперной характеристике наблюдались резкие спады (рис.22.11).
До напряжения U =4.9 В электроны, ускоренные между катодом и сеткой, сталкиваясь с атомами ртути, не передают им энергию (столкновения упругие). Если электрон в ускоряющем поле приобрёл энергию, немного превышающую 4.9 эВ, столкновение его с атомом ртути будет неупругим: атом способен воспринять
такую порцию энергии. Электрон, потеряв энергию, не может преодолеть задерживающее поле и не доходит до анода - ток падает. Следующий спад вольтамперной характеристики наблюдается, если электрон ускоряется напряжением 9.8 В и испытывает два столкновения с атомами ртути на пути к
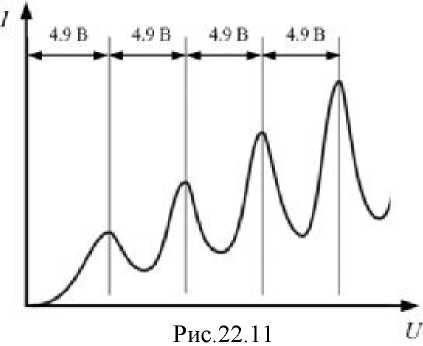 сетке, и т.д.
сетке, и т.д.
Опыт Франка и Герца показал, что энергия атома может меняться только дискретно, порциями. Более того, если напряжение превышало 4.9 В, то атомы ртути начинали излучать, переходя в основное состояние. Длина волны при этом совпадает с вычисленной из второго постулата Бора:
eU = DE = hn = hl ^ l =.
Таким образом, был подтверждён и первый, и второй постулат Бора: энергия в изолированном атоме квантуется, а энергия излучённого фотона равна разности энергий состояний, между которыми произошёл переход.
3. Ограниченность теории Бора
Теория Бора прекрасно работает для одноэлектронных систем, но не применима уже в случае простейшего двухэлектронного атома - гелия. Причина такой ограниченности теории Бора в том, что она - полуклассическая и использует второй закон Ньютона. Тем не менее, боровская теория атома водорода:
1) даёт прекрасно согласующиеся с опытом результаты в случае одноэлектронных систем;
2) проста настолько, что позволяет решить задачу даже на уровне знаний школьника.
3) Самое главное: теория Бора была важным шагом на пути построения квантовой механики.
4. Водородоподобная система в квантовой механике
Состояние микрочастицы описывается в квантовой механике волновой функцией у (см. лекцию № 21). Она является функцией координат и времени. Квадрат модуля волновой функции определяет вероятность dP того, что частица будет обнаружена в пределах объема dV:
dP = \y |2 dV.
Волновая функция может быть найдена путем решения уравнения Шрёдингера:
D y + 2m (e - U y = 0. (22.18)
h 2
д 2y, д 2y, д 2y
Здесь Д - оператор Лапласа (D y = —2- + 2- + 2-); U -потенциальная энергия частицы. Уравнение Шрёдингера является основным уравнением квантовой механики. Подобно тому, как уравнения динамики Ньютона не могут быть получены теоретически, а представляют собой обобщение большого числа опытных фактов, уравнение Шрёдингера также нельзя вывести из каких-либо известных ранее соотношений. Его следует рассматривать как исходное основное предположение, справедливость которого доказывается тем, что все вытекающие из него следствия согласуются с опытом.
В атоме водорода или водородоподобном ионе потенциальная энергия электрона равна:
Ze 2
| (22.19) |
4p£q Г
Уравнение Шрёдингера имеет в этом случае вид:
| 2т |
| (22.2q) |
| Ze 2 4p£q Г |
| y = Q. J |
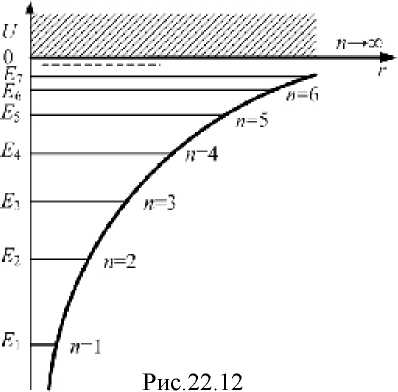
Можно показать, что (22.2Q) имеет однозначные, конечные и непрерывные решения в следующих случаях (рис.22.12):
1) при любых положительных значениях Е;
2) при дискретных отрицательных значениях энергии, равных:
| E= n |
------------- •-.
2 12 2 ’
8 s q • h n
Случай E>Q соответствует электрону, пролетающему вблизи ядра и удаляющемуся вновь на бесконечность. Случай E<Q
соответствует электрону, находящемуся в пределах атома. Квантовая механика приводит к таким же значениям энергии водородного атома, какие получались и в теории Бора (22.15). Однако в квантовой механике эти значения получаются естественно при решении уравнения Шрёдингера. Бору же для получения такого результата пришлось вводить специальные дополнительные предположения.
5. Квантовые числа
Значения энергии En, при которых уравнение Шредингера имеет решение, называются собственными значениями, а соответствующие им волновые функции - собственными функциями. Собственные функции уравнения (22.2Q) содержат три целочисленных параметра. Один из них совпадает с номером уровня энергии п, два других принято обозначать буквами l и mi. Эти числа называют квантовыми:
1) n - главное квантовое число; оно определяет энергию (22.15) водородоподобной системы и размеры электронного облака;
2) 1 - орбитальное (или азимутальное) квантовое число; оно определяет форму электронного облака и величину орбитального момента импульса электрона (механического момента):
Ll = hy/1 -(1 +1), (22.21)
а также связанного с ним магнитного момента
e r
Pl =-z-Lt; (22.22)
2me
3) m1 - магнитное квантовое число; оно определяет проекцию момента импульса на заданное направление в пространстве:
(L)г = m-i - П. (22.23)
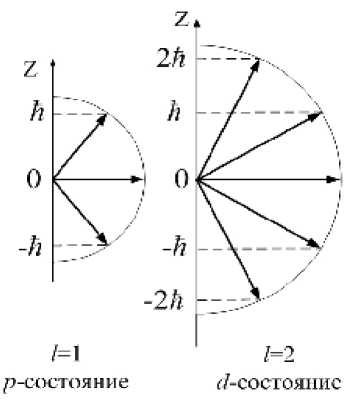
При заданном n числа 1 и т1 могут принимать следующие значения: 1 =0, 1, 2,..., (n -1), то есть всего n значений;
т1 =0, ±1,..., ±(1), то есть всего (2 1 +1) значений.
| Рис.22.13 |
1 =0 - 5 -состояние,
1 =1 - p -состояние,
1 =2 - d -состояние,
1 =3 - / -состояние и так далее.
Значение главного квантового числа n указывается перед условным обозначением орбитального 1. То есть, электрон в состоянии с n =3 и 1 =1 обозначается символом 3 р и т.д. Вектор L1 может принимать (2 1 +1) ориентаций в пространстве. На рис.22.13 приведены возможные ориентации вектора L1 для электронов в р - и d -состояниях.
Таким образом, каждому En, кроме E 1, соответствует несколько волновых функций yn1m, отличающихся значениями квантовых чисел 1 и т1. Это значит, что атом водорода, имея одну и ту же энергию, может находиться в нескольких различных состояниях. Такие состояния называются вырожденными. Кратность вырождения энергетического уровня с номером n равна n 2:
n -1
^(2 1 +1) = n 2. (22.24)
1 =0
Во внешнем магнитном поле атом, обладающий магнитным моментом (с 1 /0), приобретает дополнительную энергию, зависящую от проекции момента, то есть от т1. Это значит, что вырождение по квантовому числу т1 снимается. Уровень
расщепляется на (2l +1) подуровней, расстояние между которыми зависит от величины внешнего поля; спектр усложняется. Это - эффект Зеемана (нормальный эффект Зеемана).
В слабых магнитных полях наблюдается аномальный эффект Зеемана; он объясняется наличием спина у электрона (см. дальше). Расщепление уровней наблюдается также во внешнем электрическом поле; это - эффект Штарка.
Вычисление волновой функции у, исходя из уравнения Шрёдингера, вообще говоря, является очень сложной математической задачей. Для всех состояний, кроме 5 -состояния, она не может быть выражена в элементарных функциях. Рисунки 22.14 и 22.15 дают некоторое представление о распределении плотности вероятности (форме электронного облака) для s-, р- и J -состояний.
Устоявшийся термин «электронная плотность» может ввести в заблуждение.
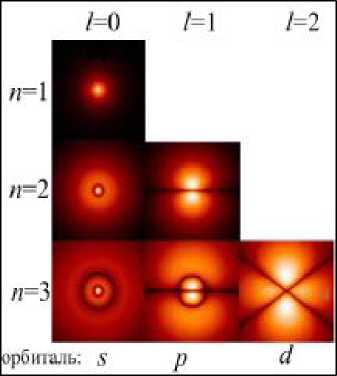
| Рис.22.14 |
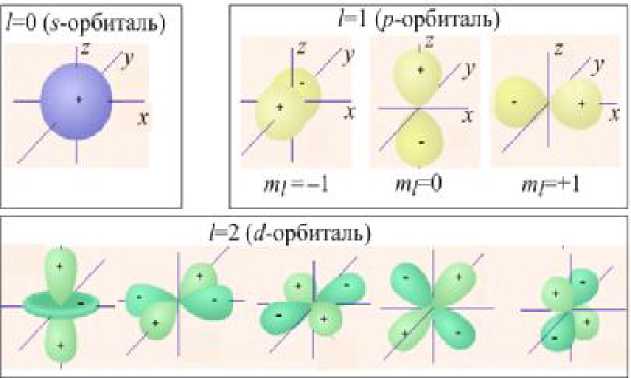
| Рис.22.15 |
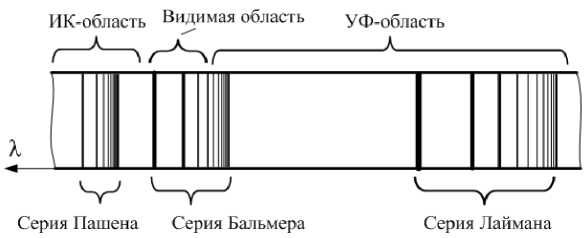
| 6. Спектр атома водорода Спектр атома водорода приведён на |
| Рис.22.16 |
Когда говорят о «плотности электронного облака», это не значит, что электрон «размазан» в пространстве по этому электронному облаку. Электрон дискретен и неделим. Речь идёт именно о пространственном представлении волновой функции, квадрат модуля которой равен плотности вероятности обнаружения электрона в той или иной точке пространства.
На рис. 22.15 указан знак самой у -функции в соответствующих точках.
рис.22.16. Спектральные линии группируются в серии. Схема уровней энергии атома водорода дана на рис.22.17. Уровни, отвечающие состояниям с
различными значениями
квантового числа l, помещены в разных столбцах. Испускание и поглощение света происходит при переходе электрона с одного
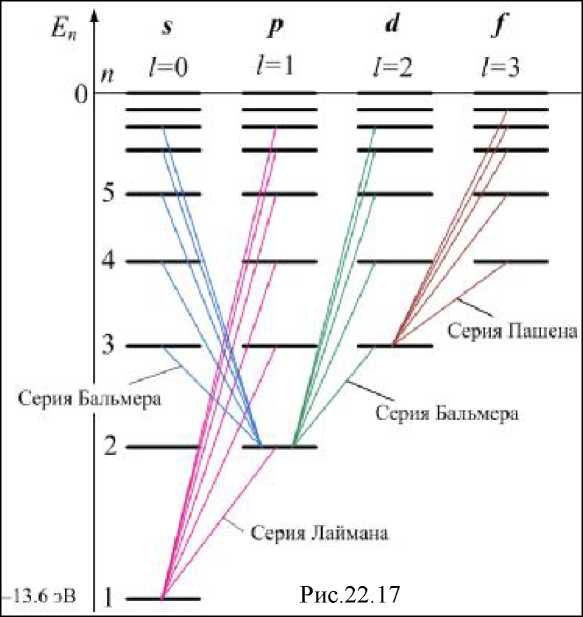 уровня на другой. В квантовой механике доказывается, что для орбитального квантового числа имеется правило отбора
уровня на другой. В квантовой механике доказывается, что для орбитального квантового числа имеется правило отбора
Dl = ±1. (22.25)
Это означает, что возможны только такие переходы, при которых l изменяется на единицу. Правило (22.25) обусловлено тем, что фотон обладает собственным моментом импульса (спином). При испускании фотон уносит из атома этот момент, а при поглощении привносит, так что правило отбора (22.25) есть следствие закона сохранения момента импульса.
На рис.22.17 показаны переходы, разрешённые правилом (22.25). Пользуясь условными обозначениями состояний электрона, переходы, приводящие к возникновению серии Лаймана, можно записать в виде np^ls (п=2, 3,...); серии Бальмера соответствуют переходы ns^2p и nd^2p (п=3, 4,...), и т.д.
Квантовая механика даёт то же выражение для энергии атома водорода, что и теория Бора; так что нет нужды повторять вывод сериальной формулы Бальмера- Ритца (22.2).
Как уже было сказано, любая спектральная линия атома
водорода может быть представлена в виде разности спектральных R термов T (п) = —: п 2
l = T (п)- T (m). (22.26)
Спектральный терм T(п) - функция квантового числа,
пропорциональная энергии атома в данном стационарном состоянии. Термин «терм» используется также для обозначения самого
стационарного состояния атома, однозначно определяющегося, в общем случае, набором квантовых чисел.
7. Спин электрона. Спиновое квантовое число. Полный момент одноэлектронного атома
Исследование спектров водорода при помощи приборов с большой разрешающей способностью показало, что каждая линия является двойной (дублетом). Это - тонкая структура спектра. Расщепление спектральных линий обусловлено расщеплением энергетических уровней: уровни с l>0 двойные. Для объяснения расщепления уровней в 1925 году была выдвинута гипотеза о том, что электрон обладает собственным моментом импульса Ls, не связанным с орбитальным движением. Этот собственный момент был назван спином .
Первоначально предполагалось, что спин обусловлен вращением электрона вокруг своей оси. Но вскоре от этих представлений пришлось отказаться по следующей причине. Вращающийся заряженный шарик должен обладать
магнитным моментом, причём отношение магнитного момента к механическому принципа неопределённостей Гейзенберга: если Ls и (Ls)z имеют определённые значения, то (Ls) х и (Ls)? при этом не определены.
| должно иметь значение, равное |
| (см. лекцию № 15). Однако ряд |
| I 2me 0 |
| опытных фактов даёт отношение собственных магнитного и механического моментов в два раза больше, чем для орбитальных моментов: |
| Bs _ e --- —------ Ls me |
| (22.27) |
| Таким образом, представление об электроне как о вращающемся шарике оказалось несостоятельным. Спин следует считать внутренним свойством, присущим электрону, подобно тому как ему присущи заряд или масса. Предположение о спине электрона было подтверждено большим количеством опытных данных. Оказалось также, что наличие спина и все его свойства вытекают из релятивистского уравнения квантовой механики П. Дирака, соединившего теорию относительности с квантовой механикой. Следовательно, спин является свойством одновременно квантовым и релятивистским. Спином обладают также протоны, нейтроны, фотоны и другие частицы. Спин электрона равен *Л: s =^. Спин определяет модуль собственного |
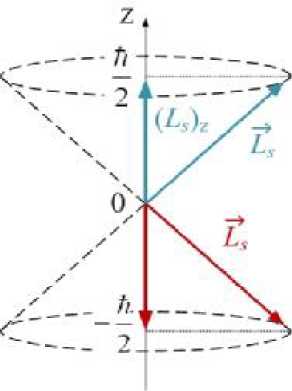
| момента импульса: |
| Ls — л,Я7й)— yj 2 ■ 3 — 2 J3. Проекция спина на заданную ось Z (например, на направление внешнего магнитного поля) может принимать квантованные значения, отличающиеся друг от друга на |
| где ms |
| (22.28) |
| (Ls) г — ms ■ h, (22.29) спиновое квантовое число. Оно может два значения: m — ± s — ±—. Величина s 2 |
|
| принимать |
| момента не может совпадать с выделенным в пространстве направлением. Это |
| приводит к тому, что направление момента в пространстве оказывается неопределённым. Известен только угол, который образует вектор Ls с направлением оси Z. Вектор Ls может иметь направление одной из образующих конуса, изображённого на рис. 22.18 (приведены оба возможных случая: ms — ± 12). Неопределённость направления момента в пространстве - следствие |
Формулы (22.27) - (22.29) позволяют найти величину собственного магнитного момента электрона ms и его проекцию msz :
| ms = —— ■ Ls = - —V s (s +1) = me me | eh л 3 r- --- — = -mB -V3; (22.30) me 2 |
e e (ti\
msz = - ~ ■ Lsz = -—[± 2) = +тв, (22.31)
где mB =— - магнетон Бора.
2me
Момент электрона слагается из двух моментов: орбитального Li и спинового Ls. Величина полного момента импульса электрона Lj определяется квантовым числом полного момента j:
Lj = hlj (j +1), (22.32)
причём j может принимать значения:
j = l + s, | l - s |, (22.33)
где l и s - соответственно орбитальное и спиновое квантовые числа. При 1 =0 квантовое число j имеет только одно значение: j = s =1. При l /0 возможны два значения
j = l +1 и j = l -1, которые соответствуют двум возможным взаимным ориентациям моментов Ll и Ls - «параллельной» и «антипараллельной». Термины взяты в кавычки,
поскольку два складываемых момента никогда не бывают направлены вдоль одной прямой.
Проекция полного механического момента электрона на направление Z определяется квантовым числом проекции полного момента m j:
(Lj)z = mj ■h, mj = -j, - J + 1, - J +2, - J - 1, j. (22.34)
С механическими моментами связаны магнитные моменты, которые взаимодействуют друг с другом подобно тому, как взаимодействуют два тока или две магнитные стрелки. Энергия этого взаимодействия зависит от взаимной ориентации моментов Ll и Ls. Следовательно, состояния с различными j должны обладать различной энергией. Таким образом, каждый терм ряда P (l =1)
расщепляется на два, соответствующих j = ^^ и j = 32 и т.п. Не расщепляется только терм S ' (l =0), так как ему соответствует только одно значение j =.