Тема урока. Углерод. Особенности строения. Гибридизация электронных облаков.
ДОМАШНЕЕ ЗАДАНИЕ.
1. Прочитать лекционный материал
2. Зарисовать схемы строения внешнего электронного слоя атома углерода.
3. Дать определение ГИБРИДИЗАЦИИ -..
*4. законспектировать способы образования SP, SP2,SP3 гибридизации (Задание для оценки 4-5).
1. Строение атома углерода
Углерод является шестым элементом периодической системы Менделеева. Его атомный вес равен 12.
Углерод находится во втором периоде системы Менделеева и в четвёртой группе этой системы.
Номер периода сообщает нам, что шесть электронов углерода располагаются на двух энергетических уровнях.
А четвёртый номер группы говорит, что на внешнем энергетическом уровне у углерода находится четыре электрона. Два из них, это спаренные s -электроны, а два другие – не спаренные р -электроны.
Структура внешнего электронного слоя атома углерода может быть выражена следующими схемами:
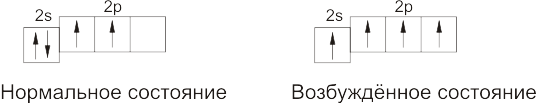
Каждая ячейка в этих схемах означает отдельную электронную орбиталь, стрелка – электрон, находящийся на орбитали. Две стрелки внутри одной ячейки – это два электрона, находящиеся на одной орбитали, но имеющие противоположно направленные спины.
При возбуждении атома (при сообщении ему энергии) один из спаренных S -электронов занимает р -орбиталь.
Возбуждённый атом углерода может участвовать в образовании четырёх ковалентных связей. Поэтому в подавляющем большинстве своих соединений углерод проявляет валентность, равную четырем.
Так, простейшее органическое соединение углеводород метан имеет состав СН4. Строение его может быть выражено структурной или электронной формулами:
Особенность свойств углерода.
Количество электронов на внешнем энергетическом уровне является главным фактором, определяющим химические свойства элемента.
В левой части периодической системы расположены элементы с малозаполненным внешним электронным уровнем. У элементов первой группы на внешнем уровне один электрон, у элементов второй группы – два.
Элементы этих двух групп являются металлами. Они легко окисляются, т.е. теряют свои внешние электроны и превращаются в положительные ионы.
В правой части периодической системы, наоборот, находятся неметаллы (окислители). В сравнении с металлами они обладают ядром с большим числом протонов. Такое массивное ядро обеспечивает гораздо более сильное притяжение своего электронного облака.
Такие элементы с большим трудом теряют свои электроны, зато непрочь присоединить к себе дополнительные электроны других атомов, т.е. окислить их, а самим, при этом, превратиться в отрицательный ион.
Металлические свойства элементов по мере возрастания номера группы в периодической системе ослабляются, а их способность окислять другие элементы увеличивается.
Углерод находится в четвёртой группе, т.е. как раз посередине между металлами, легко отдающими электроны, и неметаллами, легко эти электроны присоединяющими.
По этой причине углерод не обладает ярко выраженной склонности отдавать или присоединять электроны.
2. Типы гибридизации. Известны три вида гибридных облаков.
SP гибридизация, характерна для алкан
SP2- гибридизация характерна для алкен
SP3 – гибридизация характерна для алкин.
Гибридизация – процесс смешения разных, но близких по энергии, орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по форме и энергии.
1. sp3-гибридизация. Одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые «гибридные» орбитали, угол между осями которых равен 109° 28'.

Молекулы, в которых осуществляется sp3-гибридизация, имеют тетраэдричную геометрию (CH4, NH3).
2. sp2-гибридизация. Одна s-орбиталь и две p-орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°.
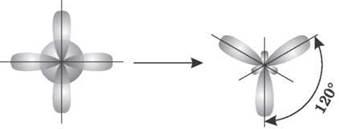
Если связь образуется в результате перекрывания орбиталей по линии, соединяющей ядра атомов, называется σ-связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется п-связь. Три sp2-орбитали могут образовывать три σ-связи (BF3, AlCl3). Еще одна связь (п-связь) может образоваться, если на p-орбитали, не участвующей в гибридизации, находится электрон (этилен C2H4).
Молекулы, в которых происходит sp2-гибридизация, имеют плоскую геометрию.
3. sp-гибридизация. Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°.

Две sp-орбитали могут образовывать две σ-связи (BeH2, ZnCl2). Еще две p-связи могут образоваться, если на двух p-орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2H2).
Молекулы, в которых происходит sp-гибридизация, имеют линейную геометрию (C2H2, HCN).