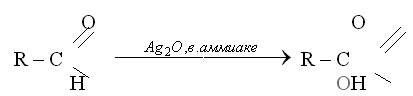- Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, с одним из которых связана функциональная группа.
- Пронумеруйте атомы углерода в главной цепи, начиная с того конца, к которому ближе функциональная группа.
- Назовите соединение по алгоритму для углеводородов.
- В конце названия допишите суффикс -ол и укажите номер атома углерода, с которым связана функциональная группа.
В зависимости от характера атома Углерода, с которым соединена гидроксогруппа, спирты делятся на первичные, если гидроксильная группа размещена у первичного атома Углерода, вторичные, если гидроксильная группа размещена у вторичного атома Углерода, и третичные, если гидроксильная группа размещена у третичного атома Углерода.
Первичные СН3 – СН2 – СН2- ОН
Пропанол-1
С6Н5-СН2- ОН
Фенилметанол
Вторичные СН3 – СН – СН3
½
ОН
Пропанол-2
СН3
½
Третичные СН3 – СН – СН3
½
ОН
2-Метилпропанол-2
Если в молекуле спирта есть одна гидроксильная группа, то он называется одноатомным, две - двухатомным, три - трьохатомным и т. д. Простейшими представителями одноатомных, двухатомным и трьохатомных спиртов соответственно являются метанол, этиленгликоль и глицерин:
Физические свойства спиртов во многом определяются наличием между молекулами этих веществ водородных связей:
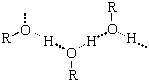
С этим же связана и хорошая растворимость в воде низших спиртов.
Табл.: Физические свойства спиртов и фенолов:
| Название | Формула | d420 | tплC | tкипC |
| Спирты | ||||
| метиловый | СН3OH | 0, 792 | -97 | |
| этиловый | С2Н5OH | 0,79 | -114 | |
| пропиловый | СН3СН2СН2OH | 0,804 | -120 | |
| изопропиловый | СН3–СН(ОH)–СH3 | 0,786 | -88 | |
| бутиловый | CH3CH2CH2CH2OH | 0,81 | -90 | |
| вторбутиловый | CH3CH2CH(CH3)OH | 0,808 | -115 | |
| третбутиловый | (СН3)3С–OH | 0,79 | +25 | |
| циклогексанол | С6Н11OH | 0,962 | -24 | |
| бензиловый | C6H5CH2OH | 1,046 | -15 | |
| этиленгликоль | HOCH2CH2OH | 1,113 | -15,5 | |
| глицерин | НО–СН2–CH(ОН)–СН2OH | 1,261 | -18,2 | |
| Фенолы | ||||
| фенол | С6Н5OH | 1,05(43°) | ||
| пирокатехин | о - С6Н4(OH)2 | – | ||
| резорцин | м - С6Н4(OH)2 | – | ||
| гидрохинон | n - С6Н4(OH)2 | – |
Простейшие спирты - жидкости с характерными запахами. С увеличением числа атомов углерода температура кипения возрастает, а растворимость в воде падает. Температура кипения у первичных спиртов больше, чем у вторичных спиртов, а у вторичных - больше, чем у третичных. Метанол крайне ядовит. Метанол. Наружно метанол подобный этанолу, но имеет сильное ядовитое действие и поэтому довольно опасный.
Используется для синтеза формальдегида, а также для получения лекарств, мономеров, красителей и как растворитель.
Ядовитые свойства метанола вызваны его способностью окисляться в организме человека до формальдегида и муравьиной кислоты, которые разрушают белковые клетки (10 г вызывает слепоту, а 30 г - смертельная
доза для человека).
Применение спиртов:
Этиленгликоль применяют: 1) в качестве антифриза; 2) для синтеза высокомолекулярных соединений (например, лавсана). Глицерин применяют:1) в парфюмерии и в медицине (для изготовления мазей, смягчающих кожу); 2) в кожевенном производстве и в текстильной промышленности; 3) для производства нитроглицерина.
Этанол. Этанол имеет многоплановое применение. Это один из лучших растворителей для многих органических соединений - подобно воде для неорганических. Добывают брожением углеводов. Из этанола получают уксусную кислоту, эфиры - этилацетат, бутилацетат и т.п. Его применяют для синтеза практически всех классов органических соединений.
Этанол используется в пищевой промышленности в процессах изготовления пива, вин и других спиртных напитков.
Этанол действует на организм человека как наркотик и в небольшой дозе вызывает опьянение, а в больших количествах может привести к смерти.
Пропиловые спирты. 1-пропанол используют для добывания пропионового альдегида. 2-пропанол применяется для синтеза различных химических продуктов.
Бутиловые спирты. Применяются как растворители лаков и красок, для синтеза эфиров, бутиратной кислоты.
Высшие жирные спирты. Жидкие (6 - 10 атомов Углерода), применяют как промежуточные продукты в производстве моющих средств, пластификаторов, флотореагентов, в фармацевтической и парфюмерной промышленности.
Твердые (цетиловый – С16Н33ОН) - является основной частью спермацета - жирового вещества, которое находится в черепной полости кашалота - в виде эстера пальмитиновой кислоты; цериловый – С26Н53ОН, мирициловый С30Н61ОН - входят в состав пчелиного воска.
Химические свойства спиртов:
1.Горение: C2H5OH + 3O2 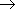 2CO2 +3H2O + Q
2CO2 +3H2O + Q
2.Реакции с щелочными и щелочноземельными металлами ("кислотные" свойства): реагируют с щелочными и щелочноземельными металлами, образуя солеобразные соединения – алкоголяты.
Атомы водорода гидроксильных групп молекул спиртов, также как и атомы водорода в молекулах воды, могут восстанавливаться атомами щелочных и щелочноземельных металлов ("замещаться" на них).
2Na + 2H—O—H 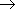 2NaOH + H2
2NaOH + H2 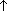
2Na + 2R—O—H 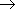 2RONa + H2
2RONa + H2 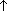
Атомы натрия легче восстанавливают те атомы водорода, у которых больше положительный частичный заряд (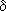 +). И в молекулах воды, и в молекулах спиртов этот заряд образуется за счет смещения в сторону атома кислорода, обладающего большой электроотрицательностью, электронных облаков (электронный пар) ковалентных связей. Молекулу спирта можно рассматривать как молекулу воды, в которой один из атомов водорода замещен углеводородным радикалом. А такой радикал, богатый электронными парами, легче, чем атом водорода, позволяет атому кислорода оттягивать на себя электронную пару связи R
+). И в молекулах воды, и в молекулах спиртов этот заряд образуется за счет смещения в сторону атома кислорода, обладающего большой электроотрицательностью, электронных облаков (электронный пар) ковалентных связей. Молекулу спирта можно рассматривать как молекулу воды, в которой один из атомов водорода замещен углеводородным радикалом. А такой радикал, богатый электронными парами, легче, чем атом водорода, позволяет атому кислорода оттягивать на себя электронную пару связи R 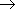 O.
O.
Атом кислорода как бы "насыщается", и за счет этого связь O—H оказывается менее поляризованной, чем в молекуле воды (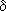 + на атоме водорода меньше, чем в молекуле воды).
+ на атоме водорода меньше, чем в молекуле воды).
В результате атомы натрия труднее восстанавливают атомы водорода в молекулах спиртов, чем в молекулах воды, и реакция идет намного медленнее.
Иногда, основываясь на этом, говорят, что кислотные свойства спиртов выражены слабее, чем кислотные свойства воды.
Из-за влияния радикала кислотные свойства спиртов убывают в ряду: метанол 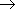 первичные спирты
первичные спирты 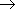 вторичные спирты
вторичные спирты 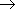 третичные спирты С твердыми щелочами и с их растворами спирты не реагируют.
третичные спирты С твердыми щелочами и с их растворами спирты не реагируют.
3. Реакции с галогеноводородами: C2H5OH + HBr 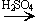 C2H5Br + H2O.
C2H5Br + H2O.
4.Внутримолекулярная дегидратация (t > 140oС, образуются алкены):
C2H5OH 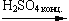 C2H4 + H2O
C2H4 + H2O
5.Межмолекулярная дегидратация (t < 140oС, образуются простые эфиры):
2C2H5OH 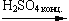 C2H5OC2H5 + H2O
C2H5OC2H5 + H2O
6.Окисление (мягкое, до альдегидов):
CH3CH2OH + CuO 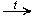 CH3—CHO + Cu + H2O Это качественная реакция на спирты: цвет осадка изменяется с черного на розовый, ощущается своеобразный "фруктовый" запах альдегида).
CH3—CHO + Cu + H2O Это качественная реакция на спирты: цвет осадка изменяется с черного на розовый, ощущается своеобразный "фруктовый" запах альдегида).
7. Взаимодействие с оганическими кислотами (реакция этерификации) приводит к образованию сложных эфиров.
| O II | O II | ||||
| CH3– | C- | -OH + H - | -OC2H5 H2SO4CH3– | C | –O–C2H5(уксусноэтиловый эфир (этилацетат)) + H2O |
В общем виде:
| O II | H+ | O II | |||||
| R– | C- | -OH + H- | -OR’ | | R– | C | –O–R’ + H2O |
Это означает, что спирты – более слабые кислоты, чем вода.
Получение спиртов:
1. Щелочной гидролиз галогеналканов (лабораторный способ): C2H5Cl + NaOH 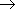 C2H5OH + NaCl.
C2H5OH + NaCl.
2. Гидратация алкенов: C2H4 + H2O 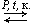 C2H5OH.
C2H5OH.
3. Брожение глюкозы: C6H12O6 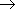 2C2H5OH + 2CO2
2C2H5OH + 2CO2 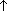 .
.
4. Синтез метанола: CO + 2H2 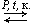 CH3OH
CH3OH
Многоатомные спирты: Примерами многоатомных спиртов является двухатомный спирт этандиол (этиленгликоль) HO—CH2—CH2—OH и трехатомный спирт пропантриол-1,2,3 (глицерин) HO—CH2—CH(OH)—CH2—OH.
Это бесцветные сиропообразные жидкости, сладкие на вкус, хорошо растворимы в воде. Этиленгликоль ядовит.
Химические свойства многоатомных спиртов по большей части сходны с химическими свойствами одноатомных спиртов, но кислотные свойства из-за влияния гидроксильных групп друг на друга выражены сильнее.
Качественной реакцией на многоатомные спирты является их реакция с гидроксидом меди(II) в щелочной среде, при этом образуется ярко-синие растворы сложных по строению веществ. Например, для глицерина состав этого соединения выражается формулой Na2[Cu(C3H6O3)2].
Глицерин получают синтетическим путем из пропилена и путем гидролиза жиров.
Альдегиды:
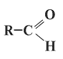
Оксосоединения - это такие органические вещества, содержащие в молекуле оксо - или карбонильную группу >C=О.
Альдегидами называются органические соединения, в молекулах которых содержится 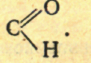 функциональная группа.
функциональная группа.
Строение молекул: Электронная и структурная формулы альдегидов следующие:
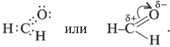
У альдегидов в альдегидной группе между атомами углерода и водорода существует  -связь, а между атомами углерода и кислорода – одна
-связь, а между атомами углерода и кислорода – одна  -связь и одна
-связь и одна  -связь, которая легко разрывается.
-связь, которая легко разрывается.
Альдегиды и кетоны отличаются по характеру атомов, окружающих карбонильную группу: у альдегидов хотя бы одна из валентностей Углерода карбонильной группы тратится на связь с Гидрогеном.
У кетонов обе валентности карбонильной группы тратятся на связь с углеводородными остатками:
R - С = О R - С = О
| |
Н R1
Получение альдегидов: В промышленности:
а) окислением алканов: 
б) окислением алкенов: 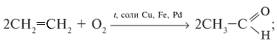
в) гидратацией алкинов: 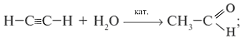
г) окислением первичных спиртов: 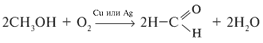
(этот метод используется и в лаборатории).
Физические свойства:
Ароматические альдегиды и кетоны - нерастворимые в воде жидкости или твердые вещества. Альдегиды имеют запах горького миндаля, а кетоны - приятный цветочный запах.
За исключением метаналя (формальдегида), который является газообразным веществом, альдегиды состава С2 – С15 – безцветные вещества, начиная с альдегида С16 в молекуле - твердые вещества.
Альдегиды с С3 – С6 имеют неприятный запах, высшие альдегиды - приятный.
Низшие кетоны (до С15 - жидкости с приятным запахом, растворимые в воде. В воде карбонильная группа образует водородные связи с молекулами воды.
Оксосоединения имеют более низкие температуры кипения, чем алканолы, что свидетельствует о слабости межмолекулярной ассоциации в альдегиды и кетоны вследствие отсутствия водородной связи. Высшие альдегиды и кетоны хорошо растворимы в органических растворителях.
Химические свойства альдегидов:
1. Из-за наличия в альдегидной группе  -связи наиболее характерны реакции присоединения:
-связи наиболее характерны реакции присоединения:
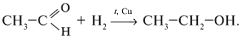
2. Реакции окисления (протекают легко):
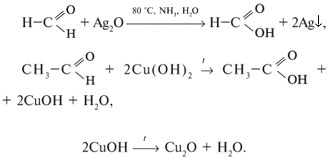
3. Реакции полимеризации и поликонденсации:
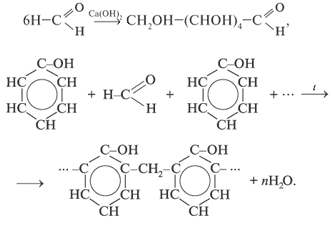
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АЛЬДЕГИДЫ. Альдегидную группу в органических соединениях можно обнаружить с помощью таких реакций, как взаимодействие со свежеосажденным гидроксидом меди(II) при нагревании,
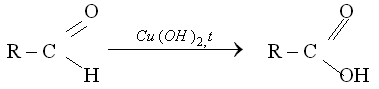
С аммиачным раствором оксида серебра {реакция серебряного зеркала).