Рассмотрим работу гальванического элемента на примере г.э. Даниэля-Якоби. Он состоит из цинкового элетрода – цинковая пластина, погруженная в раствор сульфата цинка (II), и медного электрода - медная пластинка, погруженная в раствор сульфата меди (II).
Возникновение разности потенциалов между обоими металлическими электродами объясняется различной склонностью металлов отдавать катионы в раствор электролита. У поверхности каждого из электродов возникает двойной электрический слой (см. рис.6. 2), который оказывает противодействие дальнейшему переходу катионов в раствор. Если оба металла соединить металлическим проводником (обладающим электронной проводимостью), то вследствие электропроводимости раствора электролита (ионной проводимости) получается замкнутая электрическая цепь.
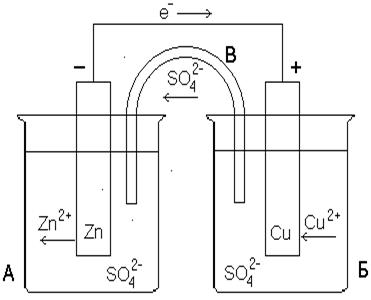
Рисунок 6. 2 Гальванический элемент Даниэля-Якоби
В этой цепи поток электронов будет перемещаться от цинка, через внешний участок цепи к меди. При этом в растворе электролита катионы будут двигаться к меди и разряжаться под действием имеющихся на нем электронов. В результате в замкнутой гальванической цепи возникнет электрический ток. Через пористую перегородку будут диффундировать ионы SO42-.
Схематически это можно записать так:
 |
(–) Zn|ZnSO4||CuSO4|Cu (+)
(–) A: Zn0 – 2e → Zn2+ – окисление;
(+) K: Cu2+ + 2e → Cu0 – восстановление;
Zn0 + Cu2+ → Zn2+ + Cu0.
Данная окислительно-восстановительная реакция лежит в основе работы гальванического элемента.
Электрод, на котором имеется избыток электронов, называется анодом. В данном случае анодом является цинковый электрод. Медный электрод будет катодом, у него недостаток электронов.
Обычно анодом является тот электрод, у которого стандартный электродный потенциал меньше по сравнению с другим электродом (см.табл.6).
Е0 Zn2+|Zn = -0,76 В;
E0 Сu2+/Сu = + 0,34 В.
Только такой выбор электродов обеспечивает положительное значение ЭДС.
Расчет ЭДС гальванического элемента
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода.
ЭДС = ЕК – ЕА.
Если условия стандартные, то ЭДС элемента Даниэля –Якоби будет равным + 1,18 В.
ЭДС = 0,34 –(–0,76) =1,18.
Если условия отличаются от стандартных, то пользуются эмпирической формулой Нернста для расчета электродных потенциалов:

 ,
,
где  – равновесный электродный потенциал, В;
– равновесный электродный потенциал, В;
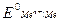 – стандартный электродный потенциал, В;
– стандартный электродный потенциал, В;
n – степень окисления металла;
R – универсальная газовая постоянная,
R = 8,31 Дж/моль К;
F – число Фарадея, F = 96500 Кл;
[Men+] – концентрация ионов металла в растворе, моль/л.
Если подставить в данную формулу значения R, F, T = 298 K и перевести натуральный логарифм в десятичный, то получится упрощенная формула Нернста:
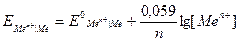 .
.
Таблица 6 – Стандартные электродные потенциалы потенциалы
| Уравнение электродного процесса | Стандартный потенциал Е ° при 25°С, В |
| Li+ + e ® Li | –3,045 |
| Rb+ + e ® Rb | –2,925 |
| K+ + e ® K | –2,924 |
| Cs+ + e ® Cs | –2,923 |
| Ca+2 + 2e ® Ca | –2,866 |
| Na+ + e ® Na | –2,714 |
| Mg2+ + 2e ® Mg | –2,363 |
| Al3+ + 3e ® Al | –1,663 |
| Ti2+ + 2e ® Ti | –1,630 |
| Mn2+ + 2e ® Mn | –1,179 |
| Zn2+ + 2e ® Zn | –0,763 |
| Cr3+ + 3e ® Cr | –0,744 |
| Fe2+ + 2e ® Fe | –0,440 |
| Cd2+ + 2e ® Cd | –0,403 |
| Co2+ + 2e ® Co | –0,277 |
| Ni2+ + 2e ® Ni | –0,250 |
| Sn2+ + 2e ® Sn | –0,136 |
| Pb2+ + 2e ® Pb | –0,126 |
| Fe3+ + 3e ® Fe | –0,037 |
| 2H+ + 2e ® H2 | 0,000 |
| Bi3+ + 3e ® Bi | 0,215 |
| Cu2+ + 2e ® Cu | 0,337 |
| Ag+ + e ® Ag | 0,799 |
| Hg2+ + 2e ® Hg | 0,850 |
| Pd2= +2e® Pd | 0,990 |
| Pt2+ + 2e ® Pt | 1,188 |
| Au+ + e ® Au | 1,692 |
Примеры решения задач:
Задача 1.
Вычислите ЭДС гальванического элемента, состоящего из двух электродов: Ti | Ti2+ (0,01 моль/л) || Ni2+ (1 моль/л) | Ni.
Решение:
ЭДС гальванического элемента можно рассчитать как разность потенциалов:
ЭДС = EК – ЕА
В данном гальваническом элементе катод - Ni° |Ni2+, а анод - Ti°|Ti2+.
Схема гальванического элемента:
А (–) Ti | Ti2+ || Ni2+ | Ni (+) К
Процессы на электродах:
(–) А: Ti – 2e- = Ti2+;
(+) K: Ni2+ + 2e- = Ni.
По формуле Нернста рассчитываем значение электродного потенциала анода.
E Ti/Ti2+ = E0 T/|Ti2+ + 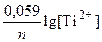 = –1,630 +
= –1,630 + 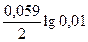 = –1,689 В;
= –1,689 В;
Значение электродного потенциала катода равно величине стандартного электродного потенциала никелевого электрода, так как концентрация ионов Ni2+ в растворе составляет 1 моль/л.
E Ni/Ni2+ = E0 Ni/Ni2+ = – 0,250 В;
ЭДС = –0,250 – (–1,689) = 1,439 В.
Задача 2.
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного оловянным и стандартным водородным электродами, если концентрация соли олова равна 0,01 моль/л.
Решение:
ЭДС гальванического элемента можно рассчитать как разность потенциалов:
ЭДС = EК – ЕА
В данном гальваническом элементе катод – стандартный водородный электрод, а анод - Sn|Sn2+.
Схема гальванического элемента:
А (–) Sn | Sn2+ || 2H+ | H2 (Pt) (+) К
Процессы на электродах:
(–) А: Sn – 2e- = Sn2+;
(+) K: 2H+ + 2e- = H2
По формуле Нернста рассчитываем значение электродного потенциала анода.
E Sn/Sn2+ = E0 Sn/|Sn2+ +  = –0,136 +
= –0,136 + 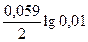 = –0,195 В;
= –0,195 В;
Значение электродного потенциала катода равно нулю.
ЭДС = 0– (–0,195) = 0,195В.
Контрольные вопросы
287. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевым электродом в растворе хлорида кадмия, [Cd2+]=0,01 моль/л и цинкового в растворе хлорида цинка, [Mg2+]=0,01 моль/л.
288. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевым электродом в растворе хлорида кадмия, [Cd2+]=0,01 моль/л и цинкового в растворе хлорида цинка, [Zn2+]=0,01 моль/л.
289. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевым электродом в растворе хлорида кадмия, [Cd2+]=0,01 моль/л и никелевого в растворе хлорида никеля, [Ni2+]=0,01 моль/л.
290. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного цинковым и магниевым электродами, погруженными в растворы солей при концентрации (моль/л) [Zn2+]=0,1, [Mg2+]=1.
291. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевым электродом в растворе хлорида кадмия, [Cd2+]=1 моль/л и цинкового в растворе хлорида цинка, [Zn2+]=0,01 моль/л.
292. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из двух свинцовых электродов, один из которых погружен в раствор соли свинца с концентрацией 0,1 моль/л, а другой – 0,0001 моль/л.
293. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного никелевым и палладиевым электродами, погруженными в растворы их солей, если [Ni2+]=0,01 моль/л, а [Pd2+]=0,1 моль/л.
294. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного оловянным и стандартным водородным электродами, если концентрация соли олова равна 0,0001 моль/л.
295. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы своих солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Вычислите ЭДС этого элемента, если [Zn2+]=0,0001 моль/л, а [Fe2+]=0,01 моль/л.
296. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного железным и стандартным водородным электродами, если концентрация соли [Fe3+] =0,001 моль/л.
297. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Mg2+]=0,01 моль/л, а [Pb2+]=0,01 моль/л.
298. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевым и стандартным водородным электродами, если концентрация соли кадмия равна 0,01 моль/л.
299. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению
Ni + Pb(NO3)2 = Ni(NO3)2 + Pb.
Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Ni2+]=0,01 моль/л, а [Pb2+]=0,0001 моль/л.
300. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного алюминиевым и стандартным водородным электродами, если концентрация соли алюминия равна 0,001 моль/л.
301. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению
Cu + 2Ag+ = Cu2+ + 2Ag.
Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Cu2+]=0,01 моль/л, а [Ag+]=1 моль/л.
302. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного серебряным и стандартным водородным электродами, если концентрация соли серебра равна 0,001 моль/л.
303. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению
Be + Pb2+ = Be2+ + Pb.
Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Pb2+]=0,01 моль/л, а [Be2+]=0,01 моль/л.
304. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного никелевым и стандартным водородным электродами, если концентрация соли никеля равна 0,0001 моль/л.
305. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению
Al + Cr3+ = Al3+ + Cr.
Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Al3+]=0,001 моль/л, а [Cr3+]=1моль/л.
306. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевыми электродами, если концентрация соли кадмия при положительном электроде равна 1 моль/л, а при отрицательном – 0,0001 моль/л.
307. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению
Cr + FeCl3= CrCl3 + Fe.
Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Fe3+]=0,01 моль/л, а [Cr3+]=0,001 моль/л.
308. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного цинковым и стандартным водородным электродами, если концентрация соли цинка равна 0,0001 моль/л.
309. Составьте схему галванического элемента, в основе которого лежит реакция, протекающая по уравнению
Co + Pb(NO3)2 = Co(NO3)2 + Pb.
Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Co2+]=0,01 моль/л, а [Pb2+]=0,0001 моль/л.
310. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного хромовым и стандартным водородным электродами, если концентрация соли хрома равна 0,001 моль/л.
311. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
312. Какой гальванический элемент называется концентрационным?
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, один из которых погружен в раствор соли серебра с концентрацией 0,1 моль/л, а другой – 0,01 моль/л.
313. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
314. Составьте схемы двух гальванических элементов, в одном из которых цинк был бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
315. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
316. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
Электролиз