Промышленные Лабораторные
Крекинг дегидрирование дегалогенирование дегидратация дегидроналогенирование
алканов алканов дигалогеноалканов спиртов галогеналканов
– крекинг алканов C8H18 → C4H8 + C4H10; (термический крекинг при 400-700 oС)
октан бутен бутан
– дегидрирование алканов C4H10 → C4H8 + H2; (t, Ni)
бутан бутен водород
– дегидрогалогенирование галогеналканов C4H9Cl + KOH → C4H8 + KCl + H2O;
хлорбутан гидроксид бутен хлорид вода
калия калия
– дегидрогалогенирование дигалогеналканов 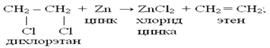
– дегидратация спиртов С2Н5ОН → С2Н4 + Н2О (при нагревании в присутствии концентрированной серной кислоты)
Запомните! При реакиях дегидрирования, дегидратации, дегидрогалогенирования и дегалогенирования нужно помнить, что водород преимущественно отрывается от менее гидрогенизированных атомов углерода (пр Зайцева)
1) Основным промышленным источником получения первых четырех членов ряда алкенов (этилена, пропилена, бутиленов и пентиленов) являются газы крекинга и пиролиза нефтепродуктов, а также газы коксования угля (этилен, пропилен). Газы крекинга и пиролиза нефтепродуктов содержат от 15 до 30% олефинов. Так, крекинг бутана при 600°С приводит к смеси водорода, метана, этана и олефинов – этилена, пропилена, псевдобутилена (бутена -2) с соотношением олефинов ≈ 3,5: 5: 1,5 соответственно.
2) Все более значительные количества алкенов получают дегидрогенизацией алканов при повышенной температуре с катализатором.
CH3–CH2–CH2–CH3 ––300°C,Cr2O3–
|
|
® CH2=CH–CH2–CH3(бутен-1) + H2
® CH3–CH=CH–CH3(бутен-2) + H2
3) В лабораторной практике наиболее распространенным способом получения алкенов является дегидратация (отщепление воды) спиртов при нагревании с водоотнимающими средствами (концентрированная серная или фосфорная кислоты) или при пропускании паров спирта над катализатором (окись алюминия).
CH3–CH2–OH(этанол) ––t°,Al2O3® CH2=CH2 + H2O
Порядок дегидратации вторичных и третичных спиртов определяется правилом А.М.Зайцева: при образовании воды атом водорода отщепляется от наименее гидрогенизированного соседнего атома углерода, т.е. с наименьшим количеством водородных атомов.
CH3–CH–CH –CH3(бутанол-2) ® CH3–CH=CH–CH3(бутен-2) + H2O -
I I
OH H
4) Часто алкены получают реакцией дегидрогалогенирования (отщепление галогеноводорода) из галогенопроизводных при действии спиртового раствора щелочи. Направление данной реакции также соответствует правилу Зайцева.
CH3–CH–CH2–CH3(2-бромбутан) + NaOH(спирт p-p) ® CH3–CH=CH–CH3 + NaBr + H2O
I
Br
5) Реакция дегалогенирования (отщепление двух атомов галогена от соседних атомов углерода) при нагревании дигалогенидов с активными металлами также приводит к алкенам.
CH2–CH –CH3(1,2-дибромпропан) + Mg ® CH2=CH–CH3(пропен) + MgBr2
I I
Br Br
IV. Закрепление изученного материала. Выполнение теста (устно)
1. Основным типом реакций, характерных для алкенов, являются реакции (выбрать нужное):
А) замещение Б) обмена В) присоединение
2. Реакция гидрирования – это реакция присоединения (выбрать нужное):
А)водорода Б) воды В) галогеноводорода
3. Реакция галогенирования – это реакция присоединения (выбрать нужное):
А)кислорода Б) галогенов В) воды
4. При реакции гидратации этена образуется (выбрать нужное):
А)этан Б) этанол
5. Качественными реакциями на алкены являются реакции обесцвечивания растворов (выбрать нужные):
А) гидроксида меди (студенистый осадок голубого цвета)
Б) бромной воды (раствор коричневого цвета)
В) хлорида железа (раствор коричневого цвета)
Г) перманганата калия (раствор малинового цвета)
6. Выбрать правильные ответы:
CH3-CH=CH2+HCl → CH3-CH2-CH2Cl
CH3-CHCl-CH3
CH3-CH=CH2+H2O → CH3 –CH-CH3
OH
CH3-CH2-CH2Cl
7. Выбрать правильные ответы:
C2H6 + O2 → CO + H2
C+ H2O
CO2 + H2O
8.Выбрать реакцию получения полипропилена:
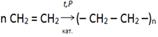
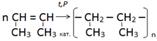
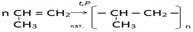
«Вырасти цветок»
Для каждой команды необходим комплект, состоящий из 9 лепестков и сердцевины
Расположить вокруг круга лепестки так, чтобы напротив формулы вещества расположилось соответствующее название вещества.

ДОМАШНЕЕ ЗАЖДАНИЕ
Задачи
1. Рассчитайте плотность пропена: а) по водороду, б) по воздуху
2. Определите объем кислорода, необходимый для сжигания 40 л октилена (н.у.)
3. Определите массу и количество вещества пентена, если в результате реакции гидрирования пентена образуется 36 г пентана.
4. Определите массу этилового спирта (г), образующегося при гидратации 112 г этилена.
5. Определите выделившуюся теплоту в результате горения 14 г этилена. Термохимическое уравнение реакции горения этилена
С2Н4 + О2 →2СО2 + 2Н2О + 1400 кДж.
6. Определите молекулярную формулу алкена, содержание углерода в котором составляет 85,7%, плотность вещества по водороду равна 21.
7. Вычислите, какая масса этанола получится при взаимодействии 1,5 моль этилена с водой, если выход продукта составляет 80%.
8. Вычислите объем бутилена, которые полностью обесцветят раствор бромной воды массой 300 г с массовой долей брома 2,5 %.
9. При взаимодействии этилена массой 2,8 г с хлором образовалось 7,92 г. дихлорэтана. Рассчитайте массовый выход продукта реакции от теоретически возможного.
10. Определите объем воздуха (л), необходимый для сжигания
21 г бутилена (н.у.)
ДОМАШНЕЕ ЗАДАНИЕ: РЕШИТЬ 3 ЛЮБЫЕ НА ВЫБОР ЗАДАЧИ. СОСТАВИТЬ КОНСПЕКТ УРОКА.