Тема «Диссоциация кислот, оснований и солей в водных растворах. Катионы и анионы. Понятие о качественных реакциях.».
Диссоциация кислот, оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H+)
Например,
HCl → H+ + Cl-
HNO3 → H+ + NO3-
Многоосновные кислоты диссоциируют ступенчато:
Н3РО4 ↔ Н+ + Н2РО-4 (первая ступень) – дигидроортофосфат ион
Н2РО-4 ↔ Н+ + НРO2-4 (вторая ступень) – гидроортофосфат ион
НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей.
Диссоциация оснований
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH-)
Диссоциация щелочей
Щёлочи – это основания, растворимые в воде (основания щелочных и щелочноземельных металлов): LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, Rа(ОН)2, а также NН4ОН
Примеры уравнений диссоциации щелочей:
KOH → K+ + OH-;
NH4OH ↔ NH+4 + OH-
Многокислотные основания диссоциируют ступенчато:
Ba(ОН)2 → Bа(ОН)+ + OH- (первая ступень)
Ba(OH)+ ↔ Ba2++OH- (вторая ступень)
Диссоциация амфотерных оснований (амфолитов)
Амфолиты - это электролиты, которые при диссоциации одновременно образуют катионы водорода (H +) и гидроксид-ионы (OH -)
Н2O ↔ Н+ + ОН-
Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением:
2ОН- + Zn2+ + 2Н2О ↔ Zn(ОН)2 + 2Н2О ↔ [Zn(ОН)4]2-+ 2Н+
Диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония (NH+4) и анионы кислотных остатков.
Диссоциация средних солей
(NH4)2SO4 → 2NH+4+ SO2-4;
Na3PO4 →3Na+ + PO3-4
Кислые и основные соли диссоциируют ступенчато.
Диссоциация кислых солей
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода.
KHSO4 → K+ + HSO-4
HSO-4 ↔ H+ + SO2-4
Диссоциация основных солей
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
MgOHCl → MgOH++ Cl-
MgOH+↔ Mg2+ + OH-
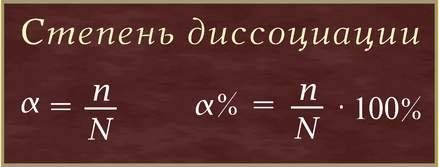
Степень электролитической диссоциации
Поскольку электролитическая диссоциация - процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Другими словами, различные электролиты, согласно теории С. Аррениуса, диссоциируют на ионы в различной степени. Полнота распада (сила электролита) характеризуется количественной величиной – степенью диссоциации.
Степень диссоциации (α – греческая буква альфа) - это отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N):
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Степень диссоциации зависит от природы электролита и растворителя, от концентрации электролита, температуры.
1. Зависимость степени диссоциации от природы: чем полярнее химическая связь в молекуле электролита и растворителя, тем сильнее выражен процесс диссоциации электролита на ионы и тем выше значение степени диссоциации.
2. Зависимость степени диссоциации от концентрации электролита: с уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается.
3. Зависимость степени диссоциации от температуры: степень диссоциации возрастает при повышении температуры (повышение температуры приводит к увеличению кинетической энергии растворённых частиц, что способствует распаду молекул на ионы).
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
Классификация электролитов в зависимости от степени электролитической диссоциации

ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ
Домашнее задание:
1. Изучить §7, 8 учебника, составить конспект (определения, важная информация, примеры реакций).
2. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ: HF, Mg(OH)2, CaCl2, Zn(NO3)2, Ba(OH)2, K2SO4, H2SiO3, FeI3, NiCl2, H3PO4, Ca(OH)2, Na2CO3, Na3PO4, HNO3, KOH, Ba(OH)2, H2SO3, Ca(NO3)2, Ca3(PO4)2, H2S, NaOH, HBr
(фото выполненных заданий скинуть в личном сообщении https://vk.com/id53950897)