Тема «Электронная природа химической связи. Электроотрицательность. Виды химической связи (ковалентная, ионная, металлическая, водородная) и механизмы ее образования. Пространственное строение молекул. Кристаллические и аморфные вещества».
Химическая связь - взаимодействие атомов, осуществляемое путём обмена электронами или их перехода от одного атома к другому.
Причиной образования химической связи является стремление системы к более устойчивому состоянию с минимально возможным запасом энергии.
Основное условие образования химической связи — понижение полной энергии системы по сравнению с суммарной энергией изолированных атомов. Молекула может образоваться только в том случае, если при взаимодействии атомов их общая энергия уменьшается. Образование химической связи всегда сопровождается выделением энергии, которая называется энергией химической связи.
Образование такой системы может идти несколькими способами и приводит к образованию соединений с различными видами химической связи. При образовании химической связи атомы стремятся приобрести устойчивую электронную оболочку.
Наиболее устойчивым является завершённый внешний энергетический уровень, который имеют атомы благородных газов. Завершённый внешний электронный уровень атомов всех благородных газов, кроме гелия, содержит восемь электронов, атом гелия — два электрона. Г. Льюис в г. предположил, что при образовании химической связи атомы стремятся изменить свои электронные оболочки до конфигурации устойчивой электронной оболочки ближайшего благородного газа, т. е. до двух, как у гелия, или до восьми электронов, как у остальных благородных газов. Это утверждение называется правилом октета (от лат. окто — восемь). Завершение внешних электронных оболочек становится возможным путём отдачи или присоединения электронов, а также путём образования общих электронных пар. Такое изменение электронных оболочек атомов приводит к образованию устойчивых структур.
Различают четыре основных вида химической связи: ковалентную, ионную, металлическую и водородную.
Важнейшей характеристикой атома при образовании химической связи является его электроотрицательность (ЭО) — способность притягивать электроны.
Ковалентная связь - химическая связь, возникающая в результате образования общих электронных пар
Если атомы неметаллов обладают одинаковой ЭО, возникает ковалентная неполярная связь. Общая электронная пара при образовании ковалентной неполярной связи в равной мере принадлежит обоим соединяющимся атомам.
Рассмотрим, каким образом образуются устойчивые электронные оболочки атомов водорода в молекуле водорода. Атому водорода до завершения внешнего уровня не хватает одного электрона, при образовании молекулы происходит объединение электронов двух атомов, в результате чего каждый атом водорода приобретает конфигурацию инертного газа гелия. В молекуле водорода атомы водорода связаны ковалентной связью.
При составлении схемы образования ковалентной связи в молекулах можно использовать следующий алгоритм:
1. определить число внешних электронов у атома неметалла и число неспаренных электронов;
2. записать символы химических элементов с обозначением внешних электронов таким образом, чтобы неспаренные электроны были обращены к соседнему символу;
3. составить схему образования ковалентной связи между атомами.
Рассмотрим также механизм образования ковалентной связи в молекуле фтора, применяя предлагаемый алгоритм. Атом фтора на внешнем электронном уровне содержит электронов — электронные пары и неспаренный электрон. До завершения электронного уровня атому фтора не хватает одного электрона. Каждый атом фтора при образовании связи предоставляет в общее пользование по одному неспаренному электрону. Это приводит к образованию общей электронной пары, в результате атомы фтора приобретают устойчивую восьмиэлектронную конфигурацию инертного газа неона:
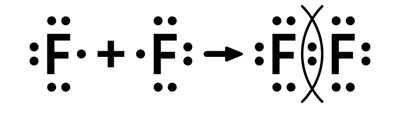
Рис. 1. Образование связи
Ковалентная связь может возникнуть не только между атомами одинаковых, но и разных элементов. Если разность ЭО атомов меньше (граница условная), то между ними возникает ковалентная полярная связь. При этом общая электронная пара смещается к атому с большей электроотрицательностью. Как правило, ковалентная полярная связь возникает между атомами неметаллов. Примерами таких соединений могут быть и др.
При соединении атомов водорода и хлора в молекулу каждый атом приобретает устойчивую завершенную оболочку: двухэлектронную, подобную оболочке гелия, у водорода и восьмиэлектронную, подобную оболочке аргона, у хлора. Однако общая электронная пара в молекуле хлороводорода смещается к более электроотрицательному атому хлора, что обозначается стрелкой:
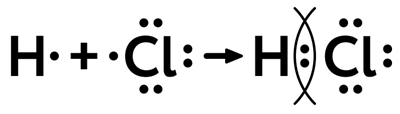
Рис. 2. Образование связи
В молекулах фтора и хлороводорода между атомами образуется одна общая электронная пара. Такая связь называется одинарной. Существуют также двойные и тройные ковалентные связи. Например, при образовании молекулы азота между атомами азота образуется не одна, а три общих электронных пары (тройная связь), так как на внешнем энергетическом уровне атома азота содержится три неспаренных электрона:
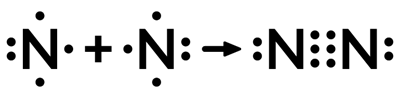
Рис. 3. Образование связи
При соединении двух атомов азота в молекулу каждый атом приобретает устойчивую завершенную восьмиэлектронную оболочку, подобную оболочке аргона неона.
В рассмотренных примерах при образовании общей электронной пары каждый из двух атомов предоставляет в совместное пользование по одному электрону. Такой механизм образования связи называется обменным.
Возможно также образование ковалентной связи по другому механизму, когда один атом предоставляет в общее пользование два электрона, а другой принимает эти электроны на свою свободную орбиталь. Атом, предоставляющий электронную пару, называется донором, а атом, принимающий на свободную орбиталь электроны — акцептором. Такой механизм образования ковалентной связи называется донорно-акцепторным.
Примером донорно-акцепторного механизма образования ковалентной связи может служить взаимодействие молекулы аммиака с ионом водорода с образованием катиона аммония:

Рис. 4. Образование катиона аммония
В молекуле аммиака атом азота, имеющий три неспаренных электрона, образует три ковалентные связи с атомами водорода по обменному механизму. При этом у азота остаётся неподеленная электронная пара, которую он предоставляет для образования связи по донорно-акцепторному механизму с ионом водорода, у которого есть свободная орбиталь. Таким образом, в катионе аммония три связи образованы по обменному механизму, а одна — по донорно-акцепторному. Все четыре связи равноценны по своим свойствам и отличаются только механизмом образования.
Донорно-акцепторный механизм образования связи характерен также для металлов побочных подгрупп, в частности железа. Молекулы гемоглобина крови, содержащие атомы железа, связывают кислород воздуха по донорно-акцепторному механизму.
Перечислим основные свойства ковалентной связи.
1. Полярность связи характеризует неравномерность распределения между атомами электронной плотности, образованной общими электронными парами. Чем больше разность электроотрицательностей атомов, тем в большей степени происходит смещение общей электронной пары, тем выше полярность связи.
Часто в молекулах с полярными ковалентными связямицентры положительного и отрицательного зарядов разделены и находятся в разных точках. Молекула с разделёнными центрами положительного и отрицательного заряда называется «диполь » («диполь » означает «двуполюсный»). Молекулы галогеноводородов, воды представляют собой диполи. Атом, к которому смещена общая электронная пара, приобретает частично отрицательный заряд. Частичный заряд обозначают греческой буквой дельта. Следовательно, атом, к которому смещена электронная пара, приобретает частично отрицательный заряд, а связанный с ним атом приобретает равный по величине, но противоположный по знаку частично положительный заряд. Чем больше значение заряда, тем больше полярность связи.
Однако не все молекулы с полярными связями являются диполями. Это во многом зависит от пространственного строения молекулы: если смещение электронной плотности одной связи полностью компенсируется другой, как, например, в молекулах, то молекула будет неполярной.
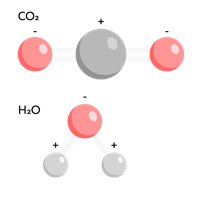
Рис. 5. Неполярная молекула (сверху) и полярная молекула (снизу) — диполь
2. Энергия связи — энергия, которую необходимо затратить, чтобы разрушить связь.
3. Длина связи — расстояние между ядрами связанных атомов, соответствующее наименьшей энергии молекулы
4. Кратность связи — число общих электронных пар, возникших между атомами. Чем выше кратность связи, тем больше её энергия и тем меньше длина, т. е. тем она прочнее.
5. Направленность связи обусловлена тем, что ковалентная связь образуется при перекрывании электронных орбиталей, которые направлены друг к другу под определенным углом. Угол между линиями, соединяющими химически связанные атомы, называется валентным углом. Например, валентный угол в молекуле равен, в молекуле —, в молекуле —, в молекуле —. Зная валентные углы в молекуле, можно определить её геометрическую форму: так, молекула воды имеет угловую форму, молекула углекислого газа — линейную.
6. Насыщаемость связи характеризует возможность образования атомом ограниченного числа ковалентных связей из-за ограниченного числа неспаренных электронов. Например, водород образует молекулу, но не молекулу; углерод может присоединить максимально четыре атома водорода с образованием молекулы метана, а молекула не может существовать.
Ионная связь - связь, которая возникает между атомами, сильно различающимися по значениям электроотрицательности.
Ионная связь возникает, например, между атомами типичных металлов и типичных неметаллов (ЭО > — величина условная).
Примерами веществ с ионной связью являются и др.
Ионную связь можно рассматривать как крайний случай ковалентной полярной связи, когда электрон практически полностью переходит от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью. Однако в действительности полного перехода электрона не происходит никогда. Даже в таких типичных ионных соединениях, как, например, в галогенидах щелочных металлов, нет полного разделения положительных и отрицательных зарядов. Так, в кристалле хлорида натрия эффективные отрицательные заряды атомов натрия и хлора составляют заряда электрона.
В результате отдачи или присоединения электронов из нейтральных атомов или молекул образуются ионы.
Ионы - заряженные частицы, образующиеся из нейтральных атомов или молекул путём отдачи или присоединении электронов.
При отдаче электронов образуется положительно заряженный ион — катион, при присоединении — отрицательный ион — анион. Атомы электроположительного элемента (металла) отдают электроны внешнего уровня и образуют катионы, а атомы электроотрицательного элемента (неметалла) присоединяют электроны и образуют анионы. При этом атомы неметалла приобретают внешнюю электронную оболочку последующего благородного газа, а атомы металла — устойчивую конфигурацию предыдущего благородного газа.
Так, между атомами типичного металла натрия (ЭО) и типичного неметалла хлора (ЭО) возникает ионная связь (ЭО). При взаимодействии натрия с хлором в результате окислительно-восстановительной реакции образуются ионы — катионы натрия и анионы хлора.
У атома натрия на внешнем электронном уровне содержится один электрон, а атому хлора до завершения внешнего уровня не хватает одного электрона. При взаимодействии атомов натрия и хлора атом натрия отдает один электрон атому хлора, в результате чего образуются ионы — катионы и анионы ‒:
При этом атомы хлора приобретают внешнюю электронную оболочку последующего благородного газа — аргона, а атомы натрия — устойчивую конфигурацию предыдущего благородного газа — неона. Между разноименно заряженными ионами и ‒ возникает электростатическое притяжение, которое приводит к образованию ионной химической связи.
Ионы могут состоять как из одного атома, так и из группы атомов. Например, кристаллы сульфата натрия образованы положительными ионами натрия и отрицательными сульфат-ионами. При этом в сульфате натрия существует два вида связи: между ионами и связь ионная, а в ионе — ковалентная полярная.
Записывая заряд иона, сначала следует написать число, а затем знак, например,.
Ионная связь существует в типичных основных оксидах (), щелочах (‒‒), солях ().
Разноименные ионы притягиваются друг к другу, образуя ионные кристаллы. В основе такого притяжения лежит кулоновское взаимодействие, которое равнонаправлено во все стороны. Поэтому ионная связь, в отличие от ковалентной, характеризуется ненаправленностью и ненасыщаемостью. Вследствие этого понятие валентности как число связей в ионных соединениях теряет смысл.
В кристаллах ионного соединения противоположно заряженные ионы чередуются. Число ближайших соседей данного иона в решетке называют координационным числом. Так, координационное число натрия и хлора в хлориде натрия равно шести.
В ионных соединениях нет отдельных молекул, поэтому формула ионного соединения выражает не состав молекулы, а соотношение катионов и анионов, например, в сульфате натрия число катионов всегда в два раза больше числа анионов.
Ионы связаны между собой прочными силами электростатического притяжения, поэтому ионные соединения твёрдые, обладают высокими температурами плавления и кипения.
Металлическая связь
Общие свойства металлов — металлический блеск, высокая тепло- и электропроводность, ковкость, пластичность — обусловлены наличием в них особого вида связи — металлической.
Металлическая связь - связь между положительными ионами металлов и общими электронами, которые свободно движутся по всему объёму.
Металлическая связь существует в простых веществах металлах (в твёрдом или расплавленном состоянии), сплавах металлов. Металлическая связь может существовать только в веществах, но не между отдельными атомами.
Рассмотрим механизм образования металлической связи. Атомы металлов легко отдают внешние электроны в общее пользование, в результате чего образуются катионы металлов и обобществленные электроны, которые легко перемещаются по всему объёму. Между ионами и свободными электронами возникают электростатические взаимодействия, которые и являются причиной возникновения металлической связи. Свободно перемещающиеся электроны обусловливают электрическую проводимость металлов.
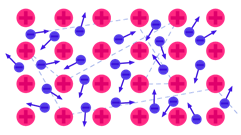
Рис. 6. Схема металлической связи
Следует отметить, что в действительности атомы в металлах ионизованы частично, электронные облака, которые они отдают в общее пользование, принадлежат и данному атому.
Металлическая связь имеет сходство как с ионной, так и с ковалентной связью. Сходство с ионной связью заключается в том, ионная связь образуется за счёт взаимодействия между заряженными частицами: электронами и ионами. Как и в случае ковалентной связи, при образовании металлической связи происходит обобществление электронов. Однако в отличие от ковалентной связи, где электроны локализованы около определенных атомов, электроны в металлах обобществляются между всеми атомами кристалла, т. е. металлическая связь делокализована.
Металлическая связь, в отличие от ковалентной связи, ненасыщаема, так как она объединяет большое число атомов, и ненаправлена, что обусловлено сферической формой -электронных орбиталей, перекрывание которых зависит только от расстояний между ними и не зависит от направлений, по которым они сближаются.
Таким образом, химическая связь имеет единую природу. Причиной единства всех типов и видов химических связей служит их одинаковая физическая природа — электронно-ядерное взаимодействие. Деление химических связей на типы носит условный характер. В веществах не реализуются типы химической связи в «чистом» виде. Так, ионную связь можно рассматривать как предельный случай ковалентной полярной связи, металлическая связь совмещает ковалентное взаимодействие атомов с помощью обобществленных электронов и электростатическое притяжение между этими электронами и ионами металлов.
В одном и том же веществе могут содержаться различные типы химических связей, например:
· в основаниях — между атомами кислорода и водорода в гидроксогруппах связь ковалентная полярная, а между металлом и гидроксогруппой — ионная;
· в солях кислородсодержащих кислот — между атомами неметалла и кислородом в кислотном остатке — ковалентная полярная, а между металлом и кислотным остатком — ионная;
· в солях аммония, метиламмония и т.д. — между атомами азота и водорода — ковалентная полярная, а между ионами аммония или метиламмония и кислотным остатком — ионная;
· в пероксидах металлов — связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом — ионная, например,).
Различные типы химических связей могут переходить одна в другую, например:
· при электролитической диссоциации в воде ковалентная полярная связь переходит в ионную;
· при испарении металлов металлическая связь переходит в ковалентную неполярную и т.д.
Водородная связь
Водородная связь - связь между электроотрицательным атомом и атомом водорода, связанным ковалентно с другим электроотрицательным атомом.
Водородная связь возникает тогда, когда атом водорода связан с электроотрицательным атомом, смещающим на себя электронную плотность и создающим при этом положительный заряд на атоме водорода. В качестве электроотрицательных атомов могут выступать фтор, кислород или азот. Водородная связь может возникать, если существует полярная связь, а у атома периода (азота, кислорода или фтора) есть свободная электронная пара. Таким образом, водородная связь имеет частично электростатическую, частично донорно-акцепторную природу.
Водородная связь возникает между молекулами воды. Более электроотрицательный атом кислорода обусловливает полярный характер связи с избытком отрицательного заряда на атоме кислорода. Атом водорода при этом приобретает частично положительный заряд и взаимодействует с неподеленными электронными парами атома кислорода в другой молекуле воды. Схематично водородная связь изображается точками:
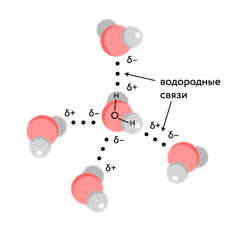
Рис. 7. Водородные связи между молекулами воды
Наличие водородных связей характерно также для аммиака и фтороводорода. Существование водородных связей между молекулами этих соединений обусловливает аномально высокие температуры кипения и плавления этих веществ по сравнению с соответствующими водородными соединениями элементов этих же групп периодической таблицы Д.И. Менделеева. Температуры кипения водородных соединений элементов группы Периодической системы — — закономерно увеличиваются вместе с ростом молекулярных масс этих соединений. Закономерный характер изменения температур кипения водородных соединений элементов группы обусловлен отсутствием водородных связей между молекулами метана, т. к. атом углерода имеет относительно невысокое значение электроотрицательности, а в молекуле метана у него отсутствует неподелённая электронная пара.
В зависимости от давления и температуры, все вещества могут существовать в различных агрегатных состояниях: твердом, жидком, газообразном или в виде плазмы. При низких температурах и высоком давлении все вещества существуют в твёрдом агрегатном состоянии. Твердое и жидкое состояние вещества называют конденсированным.
В твердых телах частицы располагаются компактно, в определенном порядке. В зависимости от степени упорядоченности частиц в твердых телах определяют 2 фазовых состояния: кристаллическое и аморфное. Если частицы располагаются таким образом, что между соседними частицами есть некоторая упорядоченность в расположении, а именно: постоянное расстояние и углы между ними, такое явление называют наличие ближнего порядка в расположении. Рис. а.
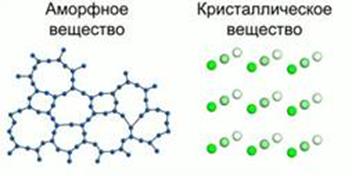
a b
Рис. 1. Наличие ближнего и дальнего порядка в расположении частиц
Если же частицы расположены таким образом, что упорядоченность наблюдается и между ближайшими соседями, и на гораздо больших расстояниях, это называют наличие дальнего порядка. Рис. б.
Примеры аморфных веществ
Аморфное тело (от греч А – не, morfe – форма) – бесформенные вещества. В них существует только ближний порядок и нет дальнего порядка.
Примеры аморфных тел приведены на рис. 2.

Рис. 2. Аморфные тела
Это воск, стекло, пластилин, смола, шоколад.
Свойства аморфных веществ
· Имеют только ближний порядок (как в жидкостях).
· Твердое агрегатное состояние при нормальных условиях.
· Нет четкой температуры плавления. Плавятся в интервале температур.
Кристаллические вещества
В кристаллическом теле существует и ближний, и дальний порядок. Если мысленно соединить точки, обозначающие линии, получится пространственный каркас, который называется кристаллической решеткой. Точки, в которых размещены частицы – ионы, атомы или молекулы – называют узлами кристаллической решетки (рис. 3). Частицы не жестко фиксированы в узлах, они могут немного колебаться, не убегая из этих точек. В зависимости от того, какие частицы находятся в узлах кристаллической решетки, выделяют её типы (табл. 1).
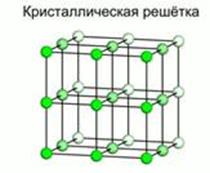
Рис. 3. Кристаллическая решетка