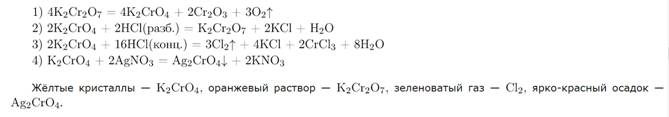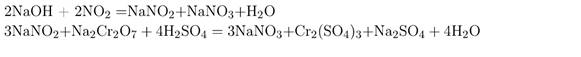Химические свойства солей
1) Диссоциация. Средние, двойные и смешанные соли диссоциируют одноступенчато. У кислых и основных солей диссоциация происходит ступенчато.
NaCl  Na+ + Cl–.
Na+ + Cl–.
КNaSO4  К+ + Na+ + SO42– .
К+ + Na+ + SO42– .
CaClBr  Ca2+ + Cl –+ Br–.
Ca2+ + Cl –+ Br–.
КHSO4  К+ + НSO4– HSO4–
К+ + НSO4– HSO4–  H+ + SO42–.
H+ + SO42–.
FeOHCl  FeOH+ + Cl– FeOH+
FeOH+ + Cl– FeOH+  Fe2+ + OH–.
Fe2+ + OH–.
[Cu(NH3)4]SO4  [Cu(NH3)4]2+ + SO42– [Cu(NH3)4]2+
[Cu(NH3)4]2+ + SO42– [Cu(NH3)4]2+  Cu2+ + 4NH3.
Cu2+ + 4NH3.
2) Взаимодействие с индикаторами. В результате гидролиза в растворах солей накапливаются ионы Н+(кислая среда) или ионы ОН– (щелочная среда). Гидролизу подвергаются растворимые соли, образованные хотя бы одним слабым электролитом. Растворы таких солей взаимодействуют с индикаторами:
индикатор + Н+ (ОН–)  окрашенное соединение.
окрашенное соединение.
AlCl3 + H2O  AlOHCl2 + HCl Al3+ + H2O
AlOHCl2 + HCl Al3+ + H2O  AlOH2+ + H+
AlOH2+ + H+
ИЗМЕНЕНИЕ ОКРАСКИ
КИСЛОТНО-ОСНОВНЫХ ИНДИКАТОРОВ
В ЗАВИСИМОСТИ ОТ pH РАСТВОРА
| Название | Окраска индикатора в среде | ||
| AlCl3 (гидролиз по катиону) Кислая среда [H+] > [OH-] рН < 7 | NaCl (гидролиз непротекает) Нейтральная [H+] = [OH-] рН = 7 | СаСO3 (гидролиз по аниону) Щелочная [OH-] > [H+] рН > 7 | |
| Лакмус | красный | фиолетовый | синий |
| Фенолфталеин | бесцветный | бесцветный | малиновый |
| Метилоранж | розовый | оранжевый | желтый |
3) Разложение при нагревании.
Многие соли устойчивы при нагревании, однако, соли аммония, некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются.
При разложении карбонатов образуются оксид металла и углекислый газ:
СаСO3 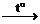 СаO + СО2.
СаO + СО2.
Если оксид металла неустойчив, то карбонат разлагается на металл, углекислый газ и кислород:
2Ag2CO3 = 4Ag + 2CO2 + O2.
Термическое разложение кислых солей с образованием средней соли
Ca(HCO3)2 = CaCO3 + CO2 + H2O
Термическое разложение основных солей
[Cu(OH)]2CO3 = 2CuO + CO2 + H2O
Соли бескислородных кислот при нагревании могут распадаться на простые вещества:
2AgCl 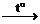 Ag + Cl2.
Ag + Cl2.
Соли аммония разлагаются с выделением аммиака:
NH4Cl = NH3 + HCl.

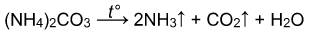
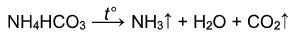
Исключение составляют нитрат и нитрит аммония:
NH4NO3 = N2O + 2H2O,
NH4NO2 = N2 + 2H2O.
Также хромат аммония:
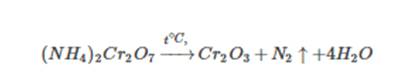



2Fe(NO3)2 = 2FeO + 4NO2 + O2.
соли
4KClO3 –без кат®KCl + 3KClO4
2KClO3 –MnO2 кат®2KCl + 3O2

4) Взаимодействие с кислотами: Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок.
2HCl + Na2CO3 ® 2NaCl + CO2 + H2O 2H+ + CO32– ® CO2 + H2O.
СaCl2 + H2SO4® CaSO4¯ + 2HCl Сa2+ + SO42-® CaSO4¯.
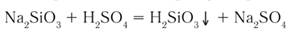
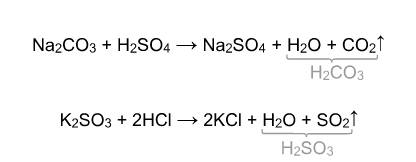
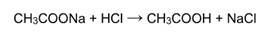
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
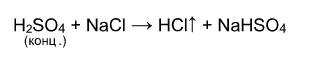
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:

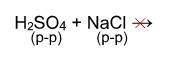
Основные соли при действии кислот переходят в средние:
FeOHCl + HCl ®FeCl2 + H2O.
Средние соли, образованные многоосновными кислотами, при взаимодействии с ними образуют кислые соли:
Na2SO4 + H2SO4® 2NaHSO4.
5) Взаимодействие со щелочами. Со щелочами реагируют соли, катионам которых соответствуют нерастворимые основания.
CuSO4 + 2NaOH ® Cu(OH)2¯ + Na2SO4 Cu2+ + 2OH– ® Cu(OH)2¯.
6) Взаимодействие друг с другом. Реакция происходит, если взаимодействуют растворимые соли и при этом образуется осадок.
AgNO3 + NaCl ® AgCl¯ + NaNO3 Ag+ + Cl– ® AgCl¯.
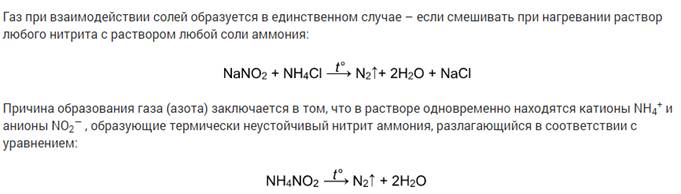
Совместный гидролиз по катиону и аниону протекает с образованием нерастворимого гидроксида и слабой кислоты: 2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3 + 6NaCl + 3CO2,
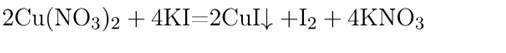
7) Взаимодействие с металлами. Каждый предыдущий металл в ряду напряжений вытесняет последующий за ним из раствора его соли:
Fe + CuSO4 ® Cu¯ + FeSO4 Fe + Cu2+ ® Cu¯ + Fe2+.
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au

Cu+2FeCl3=CuCl2+2FeCl2 (как исключение окислительно-восстановительная реакция)
8) Электролиз (разложение под действием постоянного электрического тока). Соли подвергаются электролизу в растворах и расплавах:
2NaCl + 2H2O  H2+ 2NaOH + Cl2.
H2+ 2NaOH + Cl2.
2NaClрасплав  2Na + Cl2.
2Na + Cl2.
9) Взаимодействие с кислотными оксидами.
СО2 + Na2SiO3 ® Na2CO3 + SiO2
Na2CO3 + SiO2 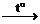 СО2+ Na2SiO3
СО2+ Na2SiO3


Кислые соли термически неустойчивы и при нагревании разлагаются с образованием средних солей:
Ca(HCO3)2 = CaCO3↓ + CO2↑ + H2O.
Для кислых солей характерны реакции нейтрализации со щелочами:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2H2O.
KHSO4 + KOH 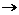 K2SO4 + H2O.
K2SO4 + H2O.
Ca(HCO3)2 + 2HCI  CaCI2 + H2O + CO2
CaCI2 + H2O + CO2 
NaH2PO4 + H2SO4 = Na2SO4 + H3PO4 идет из-за образования недиссоциированной фосфорной кислоты. B ионном виде:
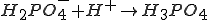
б) основные соли
Основные соли при диссоциации дают катионы металла, анионы кислотного остатка и ионы ОН—:
Fe(OH)Cl ↔ Fe(OH)+ + Cl— ↔ Fe2+ + OH— + Cl—.
Основные соли – продукты неполного замещения гидроксильных групп соответствующего основания на кислотные остатки.
Основные соли, также, как и кислые, термически неустойчивы и при нагревании разлагаются:
[Cu(OH)]2CO3 = 2CuO + CO2↑ + H2O.
Для основных солей характерны реакции нейтрализации с кислотами:
Fe(OH)Cl + HCl ↔ FeCl2 + H2O.
MgOHCI + HCI  MgCI2 + H2O.
MgCI2 + H2O.
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
(MgOH)2CO3 + Ca(OH)2 = CaCO3↓ + 2 Mg(OH)2
| Кислородосодержащие кислоты хлора | Соли |
| HСlO – хлорноватистая кислота | KСlO – гипохлорит калия |
| HСlO2 – хлористая кислота | KСlO2 – хлорит калия |
| HClO3 – хлорноватая кислота | KСlO3 – хлорат калия |
| HClO4 – хлорная кислота | KClO4 – перхлорат калия |
Особые реакции
Na2SO3 + Вr2 + Н2O = Na2SO4 + 2НВr
BaS + 4 Br2 + 4 H2O = 8 HBr↑ + BaSO4↓
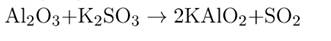
3 NaClO + KI = 3 NaCl + KIO3
5K2SO3 + 2КМnO4 + 3H2SO4 = 6K2SO4 + 2MnSO4 + 3Н2O
2Na2SO3 + O2 = 2Na2SO4
Na2SO3 + ЗС = Na2S + ЗСО
РBr3 + 3 Н2О = Н3РО3 + 3 НBr↑ (РBr3- не является солью)
РI3 + 3 Н2О = Н3РО3 + 3 НI↑ (РI3 - не является солью)