Этап индивидуальной работы
1. Скачайте файл с заданием для индивидуальной работы.
2. Разместите структурированную информацию в таблице 1 «Результаты работы с информационными источниками».
3. Просмотрите видеофрагменты опытов по взаимодействию оксидов с водой и кислотой.
4. Выполните лабораторную работу № 2.
5. В таблицу 2 «Электронное строение атомов и предполагаемые свойства оксидов и гидроксидов кальция и магния» впишите электронные формулы атомов кальция и магния, подчеркните валентные электроны и дополните выводы о наличии сходства или различия электронного строения и свойств соединений данных элементов.
6. Напишите отчет по лабораторной работе, представив полученные результаты в таблице 3 «Результаты индивидуальных наблюдений» в файле с заданием для индивидуальной работы.
7. Прикрепите свою работу в разделе «Загрузка файла» для проверки.
УЧЕБНОЕ ЗАДАНИЕ № 3 «ОБЪЯСНЕНИЕ РЕЗУЛЬТАТОВ ЛАБОРАТОРНЫХ ОПЫТОВ И СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ С УЧАСТИЕМ ОКСИДОВ И ГИДРОКСИДОВ»
Лабораторная работа № 2: «Свойства оксидов и гидроксидов кальция и магния»
Этап индивидуальной работы
1. Разместите структурированную информацию (результат работы с информационными источниками) в ниже приведенную Табл. 1.
Таблица 1. Результаты работы с информационными источниками
| тема | «Классы неорганических соединений – ОКСИДЫ» |
| форма организации информации | Оксиды — это неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
Все оксиды, по способности образовать соли, можно разделить на две группы:
Солеобразующие оксиды (CO2, N2O5,Na2O, SO3 и т. д.)
Несолеобразующие оксиды(CO, N2O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
Основные оксиды — (Оксиды металлов — Na2O, CaO, CuO и т д)
Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn2O7,CO2, N2O5, SO2, SO3 и т д)
Амфотерные оксиды (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Данная классификация основана на проявлении оксидами определенных химических свойств. Так,основным оксидам соответствуют основания, а кислотным оксидам — кислоты. Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующиеданным оксидам
: 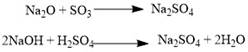 Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства
:
Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства
:  Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
CO2 – оксид углерода (IV)
N2O3 – оксид азота (III)
Химические свойства оксидов
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов)(оснований):
Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
CO2 – оксид углерода (IV)
N2O3 – оксид азота (III)
Химические свойства оксидов
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов)(оснований):
 Основные оксиды реагируют с кислотными оксидами с образованием солей:
Основные оксиды реагируют с кислотными оксидами с образованием солей:
 Аналогично реагируют и с кислотами, но с выделением воды:
Аналогично реагируют и с кислотами, но с выделением воды:
 Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
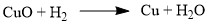 Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты:
Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты:
 Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:
Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:
 Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:
Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:
 Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:
Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:
 Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
 Амфотерные оксиды
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей:
Амфотерные оксиды
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей:
 И в реакциях с основаниями или основными оксидами проявляют кислотные свойства
:
И в реакциях с основаниями или основными оксидами проявляют кислотные свойства
: 
|
2. Впишите электронные формулы атомов кальция и магния, подчеркните валентные электроны и напишите выводы о наличии сходства или различия электронного строения и свойств соединений данных элементов:
Таблица 2. Электронное строение атомов и предполагаемые свойства оксидов и гидроксидов кальция и магния
| Электронная формула 20Сa | 20Ca 1s2 2s2 2p6 3s2 3p6 4s2 |
| Электронная формула 12Mg | 12Mg 1s2 2s2 2p6 3s2 |
| Выводы: Атомы кальция и магния имеют на внешнем электронном уровне одинаковое количество электронов – 2, поэтому являются химическими аналогами. Химические элементы кальций и магний оба находятся во 2 группе главной погруппе, но разных периодах: Са в четвёртом, а магний во втором, поэтому радиус атома кальция больше радиуса атома магния. Соответственно, металлические свойства сильнее выражены у кальция, чем у магния. |
3. Напишите отчет по лабораторной работе. Впишите в Табл. 3 результаты наблюдений, формулы соединений и уравнения происходящих реакций, выводы.
Таблица 3. Результаты индивидуальных наблюдений и предварительные соображения
| Результаты наблюдений | ||
| добавление воды и фенолфталеина к оксиду кальция | окраска раствора | Среда раствора |
| Ярко-розовая | Щелочная | |
| добавление воды и фенолфталеина к оксиду магния | Бледно-розовая | Слабощелочная |
| Уравнения реакций | ||
| Взаимодействие оксида кальция c соляной кислотой | CaO+HCl=CaCl2+H2O | |
| Взаимодействие оксида магния с соляной кислотой | MgO+HCl=MgCl2+H2O | |
| Взаимодействие оксида кальция с водой | CaO+H2O=Ca(OH)2 | |
| Взаимодействие оксида магния с водой | MgO+H2O= Mg (OH)2 (реакция протекает при нагревании) | |
| Выводы | ||
| Основные оксиды кальция и магния обладают свойствами типичных основных оксидов. При взаимодействии с растровом соляной кислоты образуют растворимые соли. Оксид кальция при взаимодействии с водой образует малорастворимое основании, которое проявляет свойства щелочей. Оксид магния вступает во взаимодействие с водой при нагревании и образует нерастворимое в воде основание. |
4. Прикрепить свою работу в разделе «Загрузка файла» для проверки.