Г. Занятие элективного курса по химии в 10 классе «Решение усложненных задач по химии» по теме: «Составление уравнений окислительно-восстановительных реакций с участием органических веществ и задачи на них»
1.Изучить теоретический материал и просмотреть видеоурок по ссылкам https://www.youtube.com/watch?v=u7Pg1ihXX6k
https://www.youtube.com/watch?v=AsFDPyy5rPA
По составлению реакций ОВР в органической химии.
Горение - это физико-химический процесс взаимодействия веществ с окислителями, чаще всего с кислородом, в результате которого происходит превращение исходных веществ в продукты сгорания, и сопровождающийся интенсивным выделением теплового излучения и света. Светящаяся зона называется пламенем.
Горение органических веществ - окислительно-восстановительная реакция. Все органические вещества сгорают на воздухе с образованием углекислого газа и паров воды. Горение углеводородов приводит к разрыву всех связей С–С и С–Н и сопровождается выделением большого количества тепла (экзотермическая реакция).
В условиях недостатка кислорода при горении может также образовываться угарный газ CO или элементарный углерод (сажа). Обычно, если органическое вещество содержит в своей структуре атомы азота, например амины, гетероциклические соединения и др., то в продуктах горения содержится молекулярный азот; если содержится хлор (хлорпроизводные), то в продуктах присутствует хлороводород HCl, если сера (тиолы, гетероциклы) – диоксид серы.
Чем больше в молекуле атомов углерода, тем более коптящим будет пламя из-за неполного сгорания и образования твердых частиц углерода (сажи), и тем больше кислорода требуется на ее сгорание. Например, метан горит голубым, этиловый спирт - почти бесцветным, а бензол – желтым коптящим пламенем.
Правила расставления степеней окисления.
1. Вычисляют среднюю степень окисления атома углерода в молекуле органического соединения, например пропана.
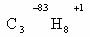
Такой подход оправдан, если в ходе реакции в органическом веществе разрушаются все химические связи (горение, полное разложение).
Отметим, что формально дробные степени окисления, вычисленные таким образом, могут быть и в случае неорганических веществ. Например, в соединении КО 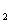 (надпероксида калия) степень окисления кислорода равна – 1/2.
(надпероксида калия) степень окисления кислорода равна – 1/2.
2. Определяют степень окисления каждого атома углерода, например в бутане.

В этом случае степень окисления любого атома углерода в органическом соединении равна алгебраической сумме чисел всех связей с атомами более электроотрицательных элементов, учитываемых со знаком «+», и числа связей с атомами водорода (или другого более электроположительного элемента), учитываемых со знаком «-». При этом связи с атомами углерода не учитывают.
В качестве простейшего примера определим степень окисления углерода в молекуле метанола.
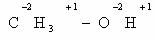
Атом углерода связан с тремя атомами водорода (эти связи учитываются со знаком «- »), одной связью – с атомом кислорода (ее учитывают со знаком «+»). Получаем:
-3 + 1 = -2
Таким образом, степень окисления углерода в метаноле равна -2.
Вычисленная степень окисления углерода хотя и условное значение, но оно указывает на характер смещения электронной плотности в молекуле, а ее изменение в результате реакции свидетельствует об имеющем место окислительно-восстановительном процессе.
Пример 1. Окисление этилена водным раствором перманганата калия при обычных условиях (реакция Вагнера):
CH2=CH2 + KMnO4 + H2O ® HO-CH2-CH2-OH + MnO2 + KOH
Степень окисления углерода в этилене – 2, в этиленгликоле – 1. В балансе учитываем оба атома углерода, так как они соединены неполярной связью.
2С -2 – 2 е ® 2С-1 3 восстановитель
Окисление
Mn+7 + 3 е ® Mn+4 2 окислитель
Восстановление
3 CH2=CH2 + 2 KMnO4 + 4H2O ® 3 HO-CH2-CH2-OH + 2 MnO2 + 2KOH
Пример 2. Окисление этаналя подкисленным раствором перманганата калия при нагревании:
CH3-CHО + KMnO4 + H2SO4 ® CH3-COOH + MnSO4+ K2SO4 + H2O
Степень окисления углерода в альдегидной группе +1, в карбоксильной группе +3, это используем в балансе, метильный радикал в реакции не участвовал, его не имеет смысла учитывать.
С+1 – 2 е ® С+3 5 восстановитель
Окисление
Mn+7 + 5 е ® Mn+2 2 окислитель
Восстановление
5 CH3-CHО + 2 KMnO4 + 3H2SO4 ® 5 CH3-COOH + 2 MnSO4+ K2SO4 + 3H2O