Теоретическая часть.
I. Сущность метода
Скорость химической реакции есть изменение концентрации вещества в единицу времени.
D + B = P (1)
Для реакции (1) уравнение скорости реакции будет выглядеть следующим образом:
dP/dt = k∙[D]∙[B] (2)
Если процесс далек от завершения, то текущие концентрации реагирующих веществ мало отличаются от исходных, значит [D]=CDи [B]=CB. После разделения переменных и интегрирования (2) получаем выражение:
[P] = k∙CD∙CB∙t (3)
В кинетических методах анализа обычно измеряют изменение [P] или пропорционального ей свойства раствора (оптическая плотность, мутность, сила тока, потенциал и т.д.) в зависимости от времени протекания реакции. При этом задают постоянной концентрацию одного из реагирующих веществ, например, CD. Если продукт реакции Р поглощает свет, то это поглощение подчиняется закону Бугера – Ламберта – Бера:
А = ε∙ ℓ∙[P] (4)
Подставляя уравнение (3) в уравнение (4), получим уравнение зависимости изменения оптической плотности от времени:
А = ε∙ℓ∙k∙CD∙CB∙t = const∙CB∙t (5)
Исходя из уравнения (5), на практике можно найти неизвестную концентрацию CB. Используют три варианта кинетического метода (рис.1): метод тангенсов, метод фиксированного времени и метод фиксированного свойства. Для метода тангенсов строят зависимость тангенса угла наклона крутого участка кривой от концентрации определяемого вещества. В методах фиксированного времени и фиксированного свойства выстраивают зависимость 1/t от концентрации и, в нашем случае, оптической плотности от концентрации.
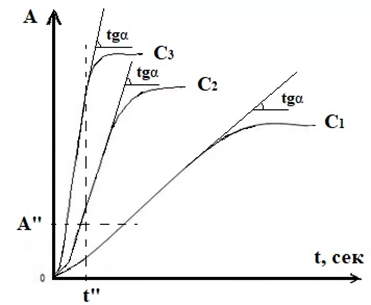
Рис.1. Три варианта кинетического метода
Реальные кинетические кривые сложнее, чем это показано на графике, но все они обладают общими принципами и закономерностями, дающими возможность использовать кинетический метод анализа. Для анализа важна средняя круто восходящая прямолинейная часть графика, показывающая интенсивное протекание реакции. Верхняя пологая часть означает, что реакция движется к своему завершению. Наличие нижнего пологого участка свидетельствует о протекании медленной стадии, предшествующей реакции, используемой в анализе.
II. Реактивы и оборудование
1. Стандартный раствор CaSO4, 0,005М.
2. BaCl2, 1% раствор в 0,1 М соляной кислоте.
3. Фотоэлектроколориметр КФК-2.
4. Секундомер.
5. Колбы мерные емкостью 50 мл, 4 шт.
Цель работы: Определение сульфат – ионов в водопроводной воде хронотурбидиметрическим методом, сравнение трех вариантов кинетического метода анализа.
Практическая часть.
1. Сравнение трех вариантов определения сульфат – иона хронотурбидиметрическим методом.
В четыре мерные колбы емкостью 50 мл внесли соответственно 1, 2, 3 и 4 мл стандартного раствора CaSO4 и разбавили дистиллированной водой до метки. Налили полученный раствор в фотоколориметрическую кювету, с толщиной поглощающего слоя 50 мм, до метки и поместили ее в кюветное отделение фотоколориметра. Внесли в кювету 1 мл осадителя (BaCl2), одновременно включив секундомер. Закрыли крышку кюветного отделения и измеряли оптическую плотность раствора с интервалом 5 секунд в течении 2-5 минут (пока кинетическая кривая не вышла на пологий участок) относительно дистиллированной воды при выбранном синем светофильтре.
| t,с | A1 | A2 | A3 | A4 |
| 0,15 | 0,18 | 0,194 | 0,239 | |
| 0,15 | 0,198 | 0,226 | 0,286 | |
| 0,132 | 0,226 | 0,268 | 0,324 | |
| 0,135 | 0,245 | 0,292 | 0,378 | |
| 0,142 | 0,265 | 0,325 | 0,425 | |
| 0,146 | 0,313 | 0,355 | 0,456 | |
| 0,148 | 0,337 | 0,368 | 0,475 | |
| 0,149 | 0,356 | 0,392 | 0,504 | |
| 0,153 | 0,377 | 0,415 | 0,52 | |
| 0,155 | 0,398 | 0,437 | 0,535 | |
| 0,16 | 0,415 | 0,458 | 0,552 | |
| 0,165 | 0,425 | 0,479 | 0,567 | |
| 0,168 | 0,432 | 0,491 | 0,577 | |
| 0,172 | 0,442 | 0,503 | 0,582 | |
| 0,178 | 0,444 | 0,515 | 0,599 | |
| 0,182 | 0,452 | 0,524 | 0,606 | |
| 0,184 | 0,46 | 0,533 | 0,615 | |
| 0,189 | 0,475 | 0,541 | 0,622 | |
| 0,189 | 0,479 | 0,553 | 0,627 | |
| 0,193 | 0,483 | 0,556 | 0,632 | |
| 0,196 | 0,485 | 0,562 | 0,635 | |
| 0,202 | 0,491 | 0,567 | 0,638 | |
| 0,203 | 0,497 | 0,569 | 0,64 | |
| 0,205 | 0,5 | 0,571 | 0,649 | |
| 0,207 | 0,502 | 0,573 | 0,652 | |
| 0,209 | 0,509 | 0,57 | 0,653 | |
| 0,217 | 0,52 | 0,579 | 0,654 | |
| 0,218 | 0,522 | 0,579 | 0,656 | |
| 0,219 | 0,524 | 0,58 | 0,657 | |
| 0,224 | 0,524 | 0,58 | 0,657 | |
| 0,225 | 0,525 | 0,58 | 0,657 | |
| 0,226 | 0,525 | 0,584 | 0,657 | |
| 0,232 | 0,526 | 0,585 | 0,657 | |
| 0,233 | 0,528 | 0,587 | ||
| 0,234 | 0,531 | 0,587 | ||
| 0,236 | 0,531 | 0,587 | ||
| 0,238 | 0,531 | 0,587 | ||
| 0,239 | 0,531 | 0,587 | ||
| 0,242 | 0,531 | 0,587 | ||
| 0,244 | 0,53 | |||
| 0,247 | 0,53 | |||
| 0,248 | ||||
| 0,251 |
Построили график зависимости А от t для всех четырех растворов:
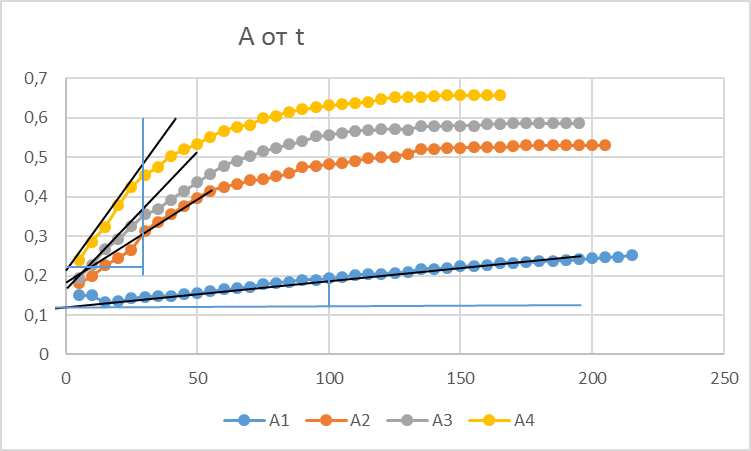
После построения графика, определили угловые коэффициенты (тангенсы углов наклона) прямолинейных участков:
tg A1 = 0,061/85 = 0,00072
tg A2 = 0,087/15 = 0,0058
tg A3 = 0,129/20 = 0,00645
tg A4 = 0,217/25 = 0,00868
C (A1) = Va*C/Vk = 4*0,005/50 = 0,0004 М
C (A2) = 3*0,005/50 = 0,0003 М
C (A3) = 2*0,005/50 = 0,0002 М
C (A4) = 1*0,005/50 = 0,0001 М
Построили зависимость тангенса от концентрации сульфат – иона. Получился график по методу тангенсов:
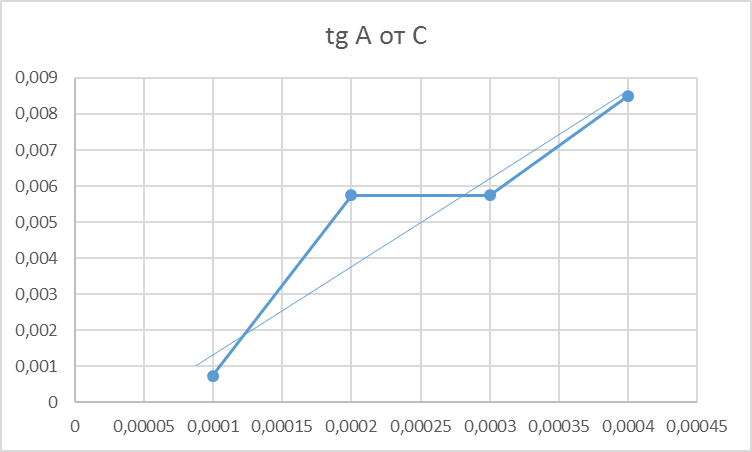
Построили график зависимости 1/t от концентрации сульфат – иона:
1) 1/t = 0,2
2) 1/t = 0,067
3) 1/t = 0,05
4) 1/t = 0,005
Аналогично провели прямую параллельную оси оптических плотностей (t”) и построили график зависимости А от концентрации сульфат – иона, таким образом получился градуировочный график по методу фиксированного времени:
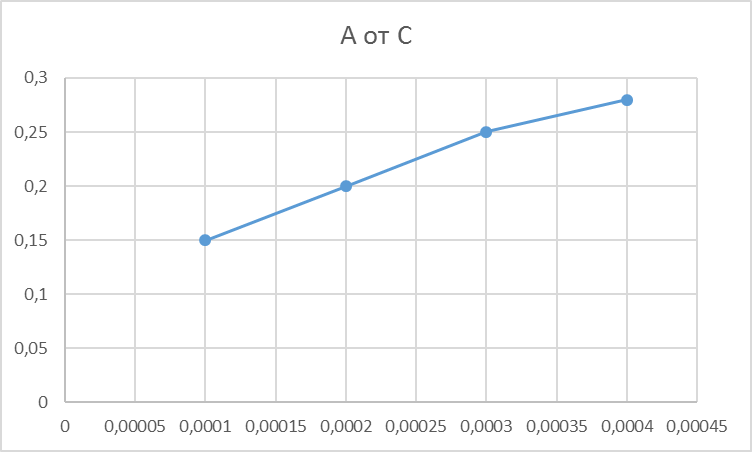
А1= 0,28
А2 = 0,25
А3 = 0,2
А4 = 0,15
Определение сульфат – ионов в водопроводной воде
Выполнили определение сульфат – ионов в водопроводной воде в трех параллелях:
| t, с | A1 | A2 | A3 |
| 0,392 | 0,381 | 0,382 | |
| 0,452 | 0,485 | 0,437 | |
| 0,535 | 0,491 | 0,521 | |
| 0,65 | 0,752 | 0,532 | |
| 0,654 | 0,792 | 0,574 | |
| 0,685 | 0,825 | 0,584 | |
| 0,712 | 0,851 | 0,707 | |
| 0,741 | 0,875 | 0,719 | |
| 0,762 | 0,892 | 0,737 | |
| 0,779 | 0,901 | 0,757 | |
| 0,791 | 0,902 | 0,772 | |
| 0,802 | 0,91 | 0,779 | |
| 0,806 | 0,913 | 0,785 | |
| 0,807 | 0,92 | 0,801 | |
| 0,812 | 0,925 | 0,807 | |
| 0,82 | 0,93 | 0,815 | |
| 0,821 | 0,941 | 0,825 | |
| 0,826 | 0,951 | 0,829 | |
| 0,826 | 0,954 | 0,834 | |
| 0,826 | 0,954 | 0,837 | |
| 0,826 | 0,957 | 0,843 | |
| 0,826 | 0,957 | 0,847 | |
| 0,826 | 0,957 | 0,847 | |
| 0,826 | 0,961 | 0,851 | |
| 0,826 | 0,961 | 0,851 | |
| 0,826 | 0,852 | ||
| 0,852 | |||
| 0,852 |
Построили кинетическую кривую зависимости А от t и нашли концентрацию сульфат – иона каждым из трех методов:
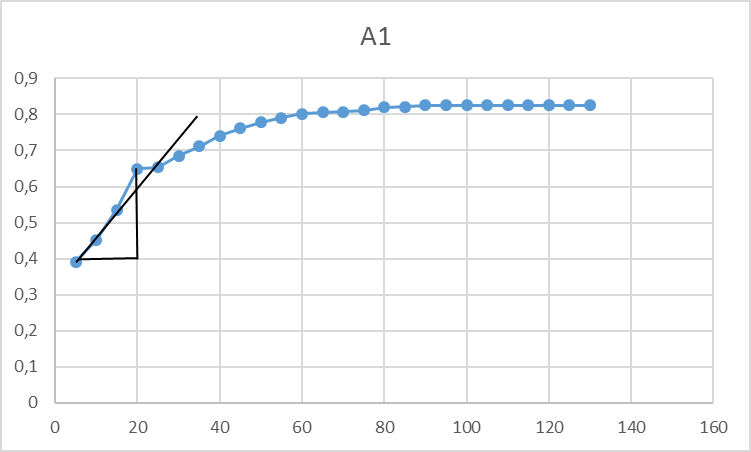
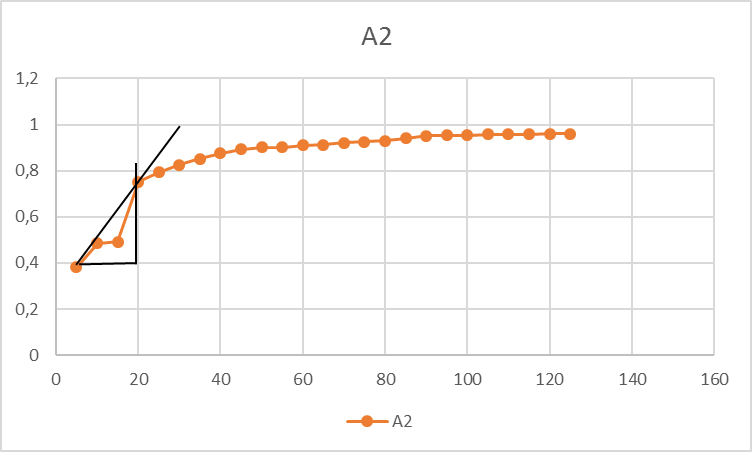
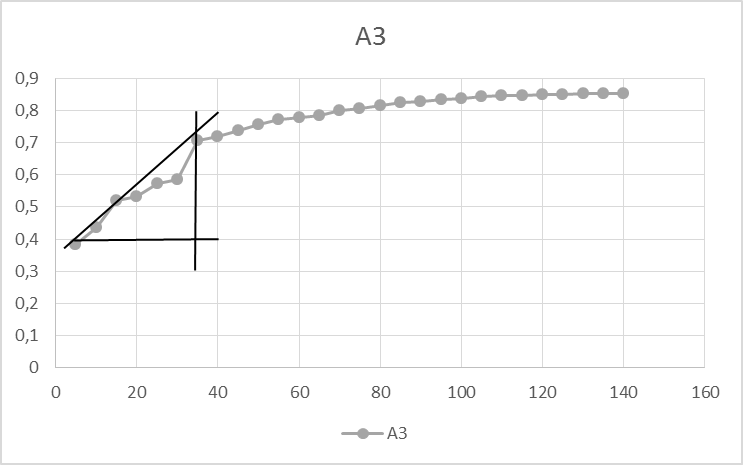
Метод тангенсов:
tg (A1) = 0,2/15 = 0,013
tg (A2) = 0,25/10 = 0,025
tg (A3) = 0,3/30 = 0,010
По графику tgA от С нашли концентрацию:
С1 = (0,013−0,001):2,235 = 0,0054 (моль/л)
C2 = (0,025-0,001):2,235 = 0,011 (моль/л)
C3 = (0,01-0,001):2,235 = 0,004 (моль/л)