Болезнь Крона
Выполнила студентка 3 курса,
медико-диагностического факультета,
группы Д-306
Цурко Виктория Александровна
Проверилаработу
Турченко Сергей Юрьевич
Гомель 2019
Содержание
| Введение | |
| Анатомия толстой кишки | |
| Этиология и патогенез | |
| Классификация болезни Крона | |
| Патоморфология болезни Крона | |
| Течение и лечение болезни Крона | |
| Список литературы | |
ВВЕДЕНИЕ
Болезнь Крона (БК) (англ.Crohn’s disease, синоним – гранулематозный энтерит, регионарный энтерит, трансмуральный илеит, терминальный илеит) – хроническое неспецифическое гранулематозное трансмуральное воспаление, которое может поражать все отделы желудочно-кишечного тракта (ЖКТ), начиная от полости рта и заканчивая прямой кишкой, с наиболее частой локализацией поражения в илеоцекальном отделе. Впервые БК описал в 1932 г. американский гастроэнтеролог Баррил Б. Крон (Burrill B. Crohn) совместно со своими коллегами Леоном Гинзбургом (Leon Ginzburg) и Гордоном Д. Оппенгеймером (Gordon D. Oppenheimer).
Распространенность болезни в мире составляет 50–70 случаев на 100 000 населения. Наиболее высокая распространенность наблюдается в скандинавских странах. Первый эпизод заболевания, как правило, возникает в возрасте от 15 до 35 лет. Мужчины и женщины поражаются одинаково часто.
Факторы, способствующие развитию болезни Крона
Ø Этничность при болезни Крона
14 пациентов, которых Крон описал в своей статье, были евреями. И хотя сам Крон отказался от гипотезы специфической чувствительности евреев к этому заболеванию, связь между еврейской этичностью и повышенным риском воспалительных заболеваний кишечника привлекла внимание исследователей. Был опубликован целый ряд работ, установивших, что в Израиле болезнь Крона и язвенный колит чаще встречаются среди евреев ашкенази - выходцев из Европы, чем среди сефардов - выходцев из Северной Африки. Более частое выявление этих заболеваний отмечено также среди евреев, проживающих в других странах. Еврейская этничность рассматривается как фактор риска развития болезни Крона и в современных эпидемиологических исследованиях. Вместе с тем накопленные к настоящему времени данные позволяют утверждать, что сегодня болезнь Крона поражает почти все этнические группы мира, включая страны, имевшие ранее низкую частоту (Япония, Южная Корея, Бразилия). Так в Японии рост заболеваемости болезнью Крона наблюдается с 1991 г., при этом отмечено, что японцы более подвержены болезни Крона, чем лица других национальностей, проживающих на той же территории. Ряд исследований показывает, что заболеваемость болезнью Крона выше у японцев, сменивших привычный тип питания на западную диету.
Ø Генетическая предрасположенность к развитию болезни Крона
Генетическая предрасположенность к болезни Крона - один из наиболее подтвержденных факторов риска. Доказательством этого служит разная частота воспалительных заболеваний кишечника в этнических группах, результаты анализа родословных больных болезнью Крона и изучения близнецов. Согласно эпидемиологическим исследованиям, проведенным в Европе, Северной Америке, Австралии, риск развития воспалительных заболеваний кишечника у родственников пациентов составляет до 10%. Наибольшему риску подвергаются родственники первой степени, особенно близнецы. Риск других родственников оценивается также не ниже 5%. Причем большую значимость этот фактор имеет именно для болезни Крона. При исследовании однояйцевых близнецов конкордантность при болезни Крона составила более 58%.
Ø Влияние курения на развитие и течение болезни Крона
Одна из теорий патогенеза болезни Крона рассматривает возможность стимуляции патологических иммунных реакций внешними токсинами у лиц с генетической предрасположенностью к заболеванию. Согласно результатам проведенных исследований, среди больных неспецифическим язвенным колитом курильщики составляли 8%, а среди пациентов с болезнью Крона - 42%. Другие исследования подтвердили, что курильщики и бывшие курильщики имеют в 4 – 5 раз более высокий риск развития болезни Крона. К тому же у больных болезнью Крона-курильщиков чаще возникали рецидивы после медикаментозного и хирургического лечения. Объяснением этих данных является повышение у курильщиков проницаемости кишечного барьера, способствующее увеличению прохождения токсинов, а также развитие под влиянием курения состояния гиперкоагуляции в результате разрушения эндотелиальных клеток, блокирования сосудистого простациклина, повышения уровня фибриногена и снижения уровня плазминогена. В свою очередь состояние гиперкоагуляции способствует очаговому повреждению интрамуральных сосудов, снижению тканевой плазминогенной активности и развитию микротромбозов в сосудах кишечника.
Ø Роль оральных контрацептивов в развитии болезни Крона
В начале 1970-х годов в печати появились сообщения о существовании связи между использованием оральных контрацептивов и развитием болезни Крона. Авторы недавно опубликованного контролируемого исследования также поддерживают гипотезу о влиянии оральных контрацептивов на развитие этого заболевания и утверждают, что почти 16% женщин больных болезнью Крона в американской популяции связаны с употреблением контрацептивов. Механизм взаимосвязи использования оральных контрацептивов и развития болезни Крона в данном случае подобен тому, что наблюдается при курении - многоочаговый гастроинтестинальный инфаркт, вызванный хроническим мезентеральным васкулитом, в дальнейшем отягощается использованием контрацептивов. Таким образом, оральные контрацептивы скорее всего должны рассматриваться как фактор, содействующий проявлению болезни Крона, а не как ее инициатор.
Ø Роль вирусных инфекций в развитии болезни Крона
Роль внутриматочной или неонатальной инфекции в развитии болезни Крона была подтверждена контролируемыми исследованиями с использованием карт наблюдения за матерями. Было выявлено 8-кратное увеличение риска развития болезни Крона в группе имевших в анамнезе такие инфекции, как ветряная оспа и корь. Детальное изучение биоптатов у пациентов с болезнью Крона и у больных воспалительными и невоспалительными заболеваниями кишечника выявило присутствие вируса кори в эндотелии, лимфоцитах и макрофагах в зоне воспаления при болезни Крона и не выявило в контрольной группе. Полученные результаты послужили основанием рассматривать васкулиты при болезни как вторично возникающие в ответ на персистирующую в эндотелии коревую инфекцию.
АНАТОМИЯ ТОЛСТОЙ КИШКИ
Знание анатомии необходимо для правильной интерпретации рентгенологического или эндоскопического исследования. Длина толстой кишки у различных людей варьирует от 90 до 150 см в зависимости от размеров тела и характера питания. Наибольший диаметр просвета наблюдается в слепой кишке, отсюда отмечается его постепенное уменьшение в дистальном направлении. Исключение составляет ампула прямой кишки, в области которой имеется расширение просвета. Диаметр просвета и длина толстой кишки изменяются при длительно существующих воспалительных заболеваниях.
С точки зрения эмбриологии в толстой кишке различают два отдела. Проксимальный отдел до середины поперечной ободочной кишки (точка Кэннона) является производным эмбриональной средней кишки, а дистальный отдел — эмбриональной задней кишки. Проксимальная половина толстой кишки выполняет в основном всасывательную функцию, а дистальная — резервуарную.
В норме характер просвета толстой кишки формируется за счёт полулунных складок (1) и гаустр (2), а также безымянных борозд и углублений, сосудистого рисунка (3), непостоянных лимфоидных фолликулов.
 Форма и размеры полулунных складок различных отделов толстой кишки отличаются друг от друга, что помогает ориентироваться в сегментах ободочной кишки при эндоскопическом исследовании без флюороскопии.
Форма и размеры полулунных складок различных отделов толстой кишки отличаются друг от друга, что помогает ориентироваться в сегментах ободочной кишки при эндоскопическом исследовании без флюороскопии.



1. Слепая кишка и илеоцекальный сфинктер.
2. Утолщенные складки восходящей кишки. Внизу виден илеоцекальный сфинктер.
3. Треугольная форма просвета в поперечно-ободочной кишке.
4. Округлая форма просвета в нисходящей ободочной кишке.
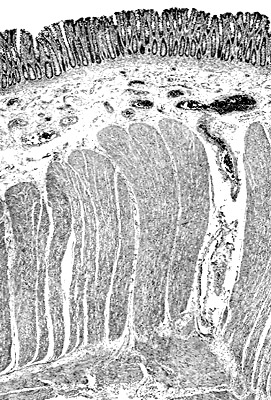 Стенка ободочной кишки представлена следующими слоями:
Стенка ободочной кишки представлена следующими слоями:
· слизистая оболочка;
· мышечная пластинка слизистой оболочки;
· подслизистый слой;
· мышечный слой;
· серозная оболочка
Поверхность слизистой оболочки выстлана одним рядом высоких цилиндрических клеток, содержащих обильное количество бокаловидных клеток. Цилиндрический эпителий продолжается внутрь крипт. Крипты или железы выстланы преимущественно бокаловидными клетками, за исключением оснований. Клетки Паннета (обеспечивают антибактериальную защиту) в толстой кишке обычно отсутствуют, исключение составляет лишь наиболее проксимальный отдел.
В основаниях крипт содержатся аргентафинные клетки (клетки APUD – системы, которые вырабатывают серотонин). Эпителий опирается на соединительно-тканную строму и собственную пластинку слизистой. Последняя образована аргирофильными волокнами, содержащими фибробласты, и в норме инфильтрирована лимфоцитами, плазматическими клетками, гистиоцитами, эозинофилами и другими лейкоцитами. Собственная пластинка содержит капилляры, но лимфатические сосуды в ней отсутствуют.
Слизистая оболочка отделена от подслизистого слоя посредством мышечной пластинки слизистой. Подслизистый слой представлен соединительной тканью, в нём сосредоточена богатая сеть кровеносных и лимфатических сосудов, а также локализуется нервное сплетение Мейснера (отвечает за секрецию в ЖКТ и местный кровоток).
Мышечная оболочка состоит из двух слоёв: внутреннего и наружного. Внутренний или циркулярный слой непрерывно охватывает кишку. Наружный или продольный слой собран в виде трёх узких мышечных лент — тений. Несмотря на это продольный слой всё же образует тончайшую оболочку. Тении приблизительно на 1/6 короче длины самой ободочной кишки, поэтому циркулярные мышечные волокна сконцентрированы в области гаустр и полулунных складок.
Вдоль наружной поверхности циркулярного слоя мышечной оболочки располагается мышечно-кишечное нервное сплетение Ауэрбаха (контролирует двигательную активность). Наружная поверхность ободочной кишки состоит из серозы, содержащей жировые привески.
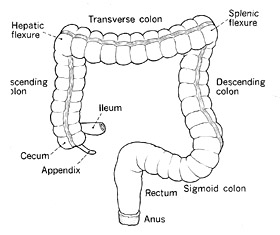 Отделы толстой кишки
Отделы толстой кишки
С лепая кишка представляет собой мешковидное выпячивание ободочной кишки ниже места впадения в неё тонкой кишки. Складки слепой кишки отличаются от таковых других отделов толстой кишки.
Восходящая кишка начинается от илеоцекального клапана и продолжается до правого подреберья, где под печенью переходит в печёночный изгиб ободочной кишки.
Восходящая ободочная кишка расположена ретроперитонеально и не имеет брыжейки. Складки восходящей кишки высокие и широкие.
В области печёночного изгиба при колоноскопии можно наблюдать голубоватое просвечивание печени через кишечную стенку. Печёночный изгиб довольно резкий и зачастую при проведении через него колоноскопа возникают технические сложности.
Поперечно-ободочная кишка пересекает верхний этаж брюшной полости от печёночного до селезёночного изгиба и лежит между восходящим и нисходящим отделами. Складки имеют треугольную форму и в каждом углу треугольника просвета проходят тении ободочной кишки.
Селезёночный изгиб является самым фиксированным отделом ободочной кишки.
Нисходящая ободочная кишка спускается в левый латеральный канал брюшной полости, располагается ретроперитонеально и граничит с латеральным краем левой почки. Складки нисходящей кишки несколько округлые, просвет узкий. По сравнению с другими отделами мышечная оболочка нисходящей кишки наиболее выражена.
Сигмовидная кишка имеет длинную брыжейку. Длина и направление сигмовидной кишки у различных людей отличается разнообразием. Выраженность складок зависит от ширины просвета: при значительном расширении просвета складки практически исчезают.
Ректосигмоидный отдел можно считать началом прямой кишки. Задняя стенка прямой кишки идёт вдоль вогнутости крестца. Полулунные складки в прямой кишке отсутствуют, поскольку она не имеет тений. В ней имеется три серповидные складки Хаустона, состоящие из слизистой, подслизистого и мышечного слоёв. Верхняя (проксимальная) складка находится приблизительно на 4 см дистальнее ректосигмоидного отдела.
Нижняя и средняя складки Хаустона располагаются приблизительно на 2-3 и 6-7 см проксимальнее зубчатой линии соответственно. При пальцевом ректальном исследовании достигается лишь нижняя складка Хаустона. Ректосигмоидный отдел является одним из самых узких сегментов толстой кишки. В дистальном направлении от него просвет постепенно расширяется и достигает максимальной ширины в ампуле прямой кишки. Дистальнее, ближе к анальному каналу, просвет вновь суживается и обычно выглядит слипшимся из-за наличия продольных анальных складок. Цилиндрический эпителий прямой кишки заканчивается на уровне зубчатой линии, сразу проксимальнее которой имеется несколько продольных складок, называемых столбиками Морганьи.
Внутренняя поверхность анального канала представлена столбиками Морганьи и гребешка. Гребешком называется средняя треть анального канала между ректальными столбиками и межсфинктерной бороздой. Особенностью анального канала является то, что в этой зоне имеется переход цилиндрического эпителия в плоский неороговевающий эпителий, называемый анодермой. В глубине анальных крипт открываются протоки анальных желез.
Физиологические сфинктеры (сужения толстой кишки.)

ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
В настоящее время нет единого взгляда на этиологию воспалительных заболеваний кишечника. По современным представлениям, болезнь Крона считается полиэтиологическим заболеванием с генетической предрасположенностью, которая позволяет реализоваться неизвестным пока повреждающим агентам. На роль последних могут претендовать бактериальные антигены и их токсины, а также аутоантигены.
К факторам, роль которых подтверждена в развитии болезни Крона относятся:
· наследственность
· микробиологические факторы
· иммунные нарушения
· нарушение интестинальной проницаемости
· патологическая активация некоторых нейропептидов
· внутрипросветные и пищевые факторы
Ø Роль наследственных факторов в развитии болезни Крона
Генетическая предрасположенность к болезни Крона - один из наиболее установленных факторов риска. Высокая заболеваемость болезнью Крона среди белых (особенно среди евреев) и семейные случаи хронических воспалительных заболеваний кишечника указывают на наследственную предрасположенность к ним. Согласно эпидемиологическим исследованиям, проведенным в Европе, Северной Америке, Австралии, риск развития воспалительных заболеваний кишечника у родственников пациентов составляет 5 - 10%. Наибольшему риску подвергаются родственники первой степени, особенно близнецы. Конкордантность по болезни Крона у однояйцовых близнецов составляет 58,3%.
Проведенные в последние 2 десятилетия генетические исследования, позволили выявить связь воспалительных заболеваний кишечника с определенными участками хромосом 16 и 12. Так, для болезни Крона подтверждена связь с перицентромерным участком хромосомы 16 и специфичность этого локуса для развития заболевания. Анализ ассоциаций генетических маркеров резистентности и предрасположенности к болезни Крона и язвенному колиту, локализованных в системе HLA, содержится в большом числе современных работ. Для болезни Крона показана положительная связь с DR1 и DQw5 аллелями.
Показана генетическая предрасположенность для развития внекишечных проявлений болезни Крона. Так для развития первичного склерозирующего холангита (ПСХ) установлена положительная связь с HLA-DR2 и отрицательная с -DR4. При отсутствии ПСХ у больных болезнью Крона HLA-B27 и HLA- B8DR3 не определяются.
Ø Микробиологические факторы в развитии болезни Крона
С момента первого описания болезни Крона проводились интенсивные поиски микроорганизмов, являющихся причиной заболевания. Предполагалось, что в возникновении и развитии патологического процесса в кишечнике при болезни Крона принимает участие какой-то бактериологический агент.
Еще в 1932 году при первом описании терминального илеита В.В. Crohn и соавтор, предположили, что причиной болезни Крона может быть инфекционный агент. И, несмотря на то что какой-то определенный инфекционный агент так и не был обнаружен, удалось выявить изменения в составе кишечной микрофлоры, в частности, в культурах облигатной анаэробной флоры найдено большое число грамположительных и грамотрицательных кокковидных палочек, не обнаруживаемых в микрофлоре лиц, входящих в контрольные группы. Позднее эта находка стала расцениваться как генетический фактор, поскольку такие же изменения были найдены у родственников пациентов с болезнью Крона.
Особое внимание исследователи уделяли L-формам бактерий, для которых характерна полиморфность, механическая и осмотическая хрупкость из-за полной или частичной утраты клеточной стенки. Патологические процессы, обусловленные L-формами, отличаются медленным развитием и хроническим течением. Было показано высокое (до 50%) содержание необычных L-форм бактерий в фильтратах гомогенизированных тканей больных болезнью Крона, в то время как в контрольных гомогенатах они обнаруживались лишь в незначительных количествах (1 - 6 %). L-формы выделялись как из пораженных, так и из непораженных участков кишечника и из лимфатических узлов больных болезнью Крона.
Как возможные причинные факторы развития болезни Крона рассматривались Pseudomonas-подобные бактерии, Streptococcus faecalis, Clostridium difficile, Escherichia coli, Chlamydia, но доказательств этиологической роли этих микроорганизмов получено не было.
Проводилось исследование роли процессов реагирования макроорганизма на бактериальные антигены при болезни Крона. Было высказано предположение, что если бактерии не являются прямой причиной болезни Крона, то не исключена вероятность того, что воспаление кишечника вызывается иммунным ответом организма, направленным против представителей местной микрофлоры.
Результаты, полученные при изучении бактериальной иммунной реактивности, позволили высказать предположение, что реакция на кишечные бактерии при болезни Крона является не первичным патогенетическим феноменом, а вторичным – в ответ на хроническое воспаление и нарушение слизистого барьера. Тем не менее концепция об участии кишечной микрофлоры в развитии болезни Крона не отвергается до настоящего времени, а совсем недавно она была поддержана экспериментальными исследованиями, в ходе которых у животных, находящихся в безмикробной среде, не удалось получить ни воспаления кишечника, ни даже ослабленной воспалительной реакции. Согласно этим исследованиям, без участия кишечной микрофлоры хроническое воспаление не развивается.
Как и при любых других заболеваниях неизвестной этиологии, при болезни Крона не исключается этиологическая роль вирусов.
Проводились исследования, связывающие болезнь Крона с вирусом кори. В исследованиях было выявлено 8-кратное увеличение риска развития болезни Крона в группе пациентов, имевших в анамнезе такие инфекции, как ветряная оспа и корь.
При электронномикроскопическом исследовании удалось идентифицировать Рагаmyxovirus-подобные включения в фокусе микроваскулярного воспаления в тканях при болезни Крона. В следствие чего рядом авторов была выдвинута так называемая коре-вирусно-мезентериально-васкулитная гипотеза развития болезни Крона, согласно которой персистирующий в организме бессимптомный вирус кори является причиной мезентериальных васкулитов и множественных очагов некроза кишечника, в результате чего развивается клиническая картина, характерная для болезни Крона.
Ø Иммунологические факторы в развитии болезни Крона
Общеизвестно, что любая острая и хроническая воспалительная реакция осуществляется с участием специфической и неспецифической активации большого числа иммунокомпетентных клеток, либо циркулирующих в крови, либо скапливающихся в месте поражения.
К настоящему времени накоплено множество данных, указывающих на иммунные нарушения – как на существенный компонент механизмов воспаления и разрушения тканей при болезни Крона.
Так была показана четкая позитивная корреляция между числом циркулирующих Т-клеток с маркером T9 (трансферриновый рецептор) - индикатором повышенной иммунной активности и степенью клинической активности заболевания, измеряемой индексом клинической активности болезни Крона и установлено, что при клиническом улучшении состояния больных болезнью Крона на фоне стандартной противовоспалительной терапии число активированных Т-клеток в крови пропорционально снижалось. Некоторые исследователи обнаружили корреляцию между активированными Т-клетками в периферической крови пациентов и такими же клетками, инфильтрирующими кишечник при болезни Крона.
В последние годы было проведено значительное количество исследований, оценивающих роль мононуклеарных клеток, формирующих воспалительный инфильтрат кишечника в активной стадии болезни Крона. Было показано, что относительные пропорции некоторых из инфильтрирующих ткань клеток, таких как подгруппы Т-клеток, практически не отличаются от тех, что обнаруживаются в слизистой оболочке в норме. В то время, как другие типы клеток, наоборот, претерпевают изменения, при этом меняется не только их число, но и тип. Например, известно, что снижение преобладающих в норме IgA-продуцирующих плазменных клеток сопровождается возрастанием в той же пропорции иммуноцитов IgG, которые обычно составляют не более 5% локальных плазменных клеток. Предполагается, что при болезни Крона состояние активации клеток слизистой оболочки кишечника также существенно меняется, на что указывает возрастание пропорции клеток с поверхностно-клеточными активными маркерами, такими как CD25 (IL-2α), T9, 4F2 и др.
С целью определения типов Т-клеток, участвующих в развитии воспалительного процесса при болезни Крона проводился анализ Т-клеточных рецепторов (TCR). В норме в слизистой оболочке кишечника человека как внутри эпителия, так и в собственной пластинке значительно больше Т-клеток с TCRαβ, чем клеток с TCRγδ. При болезни Крона возрастание числа Т-клеток в период активной стадии процесса осуществляется почти полностью за счет TCRαβ-позитивных клеток, но меняется соотношение внутриэпителиальных TCRγδ-позитивных клеток и TCRγδ-клеток собственной пластинки слизистой оболочки. По сравнению с контрольной группой пропорция толстокишечных TCRγδ-позитивных интраэпителиальных лимфоцитов и CDЗ-позитивных клеток уменьшается при болезни Крона и язвенном колите, но особенно в собственной пластинке слизистой оболочки подвздошной кишки при тонкокишечной форме болезни Крона, что заставляет предполагать уникальность изменений для каждого типа воспалительного заболевания кишечника. Итогом проведенных исследований является вывод, что Т-клетки являются важным компонентом механизма развития болезни Крона.
В недавно проведенном исследовании, анализирующем дифференциацию CD19-позитивных В-клеток в крови и кишечнике пациентов с болезнью Крона, обнаружена неожиданно высокая пропорция фенотипа CD45RO, отражающего высокий уровень В-клеточной стимуляции. Дополнительно было установлено, что больные с высоким индексом клинической активности болезни Крона имеют повышенное количество CD45RO-позитивных клеток. Это, в свою очередь указывает на взаимосвязь между степенью активности болезни Крона и стимуляцией гуморального иммунитета.
Кроме Т- и В-клеток в ответной иммунной реакции при хронических воспалительных заболеваниях кишечника участвуют и некоторые другие типы иммуноцитов, включая моноциты, макрофаги, эозинофилы, тучные клетки, базофилы. В процессе развития воспаления увеличивается количество этих клеток с активными маркерами. Однако анализ фенотипов клеток с поверхностно-клеточно-активными маркерами показал, что их иммунный статус не может служить индикатором особо высокой чувствительности и не является характерным исключительно для болезни Крона.
Ряд исследований продемонстрировал при болезни Крона чрезвычайно высокое выделение антигенов (класса HLA-DR) пораженной слизистой оболочкой кишечника. Что указывает на участие энтероцитов и колоноцитов в клеточном иммунитете и воспалении при болезни Крона. Это было подтверждено работами, показавшими, что эпителиальные клетки могут активно функционировать как атипичные антигенпредставляющие клетки. В норме кишечные эпителиальные клетки активируют преимущественно CD8-позитивные супрессорные Т-клетки, а не CD4-позитивные хелперные Т-клетки, являющиеся классическими антигенпредставляющими клетками. Это свидетельствует о том, что ответная иммунная реакция приводится в действие местной, возможно чрезмерно активной, супрессией, вызванной пищевыми или кишечными антигенами. Такая способность утрачивается при воспалительных заболеваниях кишечника из-за того, что эпителиальные клетки начинают преимущественно активировать CD4-позитивные хелперные клетки, способствуя, таким образом, нежелательной пролонгированной иммунной стимуляции и участвуя тем самым в хронической иммунной реакции при болезни Крона.
Хронизация лейкоцитарного инфильтрата в слизистой оболочке при болезни Крона - результат комплексного взаимодействия иммунокомпетентных клеток и структурных компонентов окружающей микросферы мезенхимального происхождения, играющих, как выяснилось, ту активную роль в воспалении, которая еще недавно отводилась исключительно иммунным клеткам.
Значительное число исследований по изучению иммунологических факторов болезни Крона посвящено цитокинам - растворимым медиаторам иммунных реакций, имеющим широкий спектр активности.
Цитокины подразделяются на иммунорегуляторные и провоспалительные.
Иммунорегуляторные цитокины вырабатываются в основном Т-лимфоцитами и выполняют иммуномодулирующие функции, в то время как провоспалительные являются продуктами моноцитов и макрофагов и в значительной степени ответственны за повреждение тканей.
Важная роль принадлежит интерлейкину-2 (IL-2). Он продуцируется Т-лимфоцитами в небольшом количестве и обычно не обнаруживается в крови больных болезнью Крона, но может быть легко измерен in vitro в культурах активированных мононуклеарных клеток кишечника. Проведенные исследования показывают снижение продукции IL-2 при язвенном колите и болезни Крона по сравнению с контрольной группой. Но, при этом, было обнаружено различие в ответе мононуклеарных клеток собственной пластинки слизистой оболочки на IL-2 при этих двух формах воспалительных заболеваний кишечника. Когда IL-2 использовался для стимуляции цитотоксичности мононуклеарных клеток, взятых у пациентов с болезнью Крона, то была получена резко повышенная ответная реакция, в то время как у больных язвенным колитом ответ был чрезвычайно низким, при равных экспериментальных условиях. Полученные данные послужили основанием для вывода, что, несмотря на сходство клинических проявлений, две формы хронических воспалительных заболеваний кишечника имеют противоположные иммунные механизмы: при болезни Крона иммунные ответы, опосредованные Т-клетками, могут быть значительно выраженными, при язвенном колите - чрезвычайно низкими.
При изучении иммунологических факторов болезни Крона исследовалась и система интерферонов (INF). Система интерферонов включает в себя семью родственных молекул с антивирусными и иммуномодулирующими функциями:
α-INF или лейкоцитарный INF, вырабатывается лейкоцитами при вирусной инфекции или стимуляции двухцепочной РНК
β-INF - вырабатывается фибробластами при тех же состояниях
γ-INF - или иммунный ИФН - вырабатывается лимфоцитами под действием митогенов.
α- и β-INF обнаруживают в основном антивирусную активность, а γ-INF - является регулятором клеточного и гуморального иммунитета.
Первые исследования по определению INF в крови пациентов с болезнью Крона свидетельствовали либо о его низкой концентрации, либо о его отсутствии. Недавние исследования показали более частое обнаружение повышения матричной РНК (мРНК) γ-INF и α-INF при болезни Крона, чем при язвенном колите или в контрольных клетках кишечника.
Из провоспалительных цитокинов одним из самых мощных является интерлейкин-1 (IL-1). При болезни Крона повышенные уровни IL-1 в крови обнаруживаются лишь у небольшого числа пациентов в активной стадии заболевания. В то же время этот цитокин определяется постоянно и в больших количествах в супернатантах биопсийных культур слизистой оболочки или в изолированных мононуклеарных клетках собственной пластинки как при болезни Крона, так и при язвенном колите, где его концентрация более высокая.
Исследование роли цитокинов при болезни Крона, позволило предположить наличие нарушение баланса между провоспалительной и противовоспалительной активностью. В качестве примера, подтверждающего эту гипотезу, приводятся IL-1 и его природный антагонист IL-1ra, являющийся цитокином, сходным по структуре с обеими формами IL-1. Он связывается с теми же рецепторами, что используются IL-1α и IL-1β, но захват рецептора IL-1ra создает препятствие для запуска каскада иммунных или воспалительных проявлений. В норме организм продуцирует значительно большее количество IL-1ra, чем IL-1, так что баланс между двумя цитокинами физиологически склоняется в направлении антивоспалительного статуса. Следовательно, чрезмерная продукция IL-1, не сопровождаемая параллельным возрастанием его антагониста, может изменить баланс в противоположном направлении и вызвать воспаление. Вероятность этого уже доказана при других воспалительных процессах, а недавно получила свое подтверждение и при воспалительных заболеваниях кишечника.
Как при болезни Крона, так и при язвенном колите отношение IL-1ra к IL-1, продуцируемому клетками слизистой оболочки, значительно меньше, чем в контрольных образцах. Было обращено внимание, что у больных со спонтанно разрешившимся воспалительным процессом, вызванным инфекционным заболеванием, отношение IL-1ra к IL-1 соответствует норме. Этот факт послужил основанием для утверждения, что нарушение выработки IL-1ra может быть механизмом, предрасполагающим пациента к хронизации воспаления в кишечнике.
К провоспалительным цитокинам относится также интерлейкин-6 (IL-6), вырабатываемый различными типами клеток и выполняющий те же функции, что и IL-1 и фактор некроза опухоли, действующий совместно с ними. В отличие от IL-1, IL-6 может быть определен в периферической крови больных язвенным колитом и болезнью Крона. Предпринимались попытки использовать различие уровней IL-6 в крови и тканях в качестве маркера клинической активности этих двух воспалительных заболеваний или их дифференциальной диагностики, но значительного различия концентраций этого цитокина при язвенном колите и болезни Крона обнаружено не было.
Провоспалительный интерлейкин-8, вырабатываемый моноцитами, макрофагами, нейтрофилами, эндоэпителиальными и эпителиальными клетками, фибробластами и гепатоцитами, принимает участие в развитии многих воспалительных процессов. Повышение его уровня в крови и тканях наблюдается как при язвенном колите, так и при болезни Крона.
Фактор некроза опухоли, или тумор-некротизирующий фактор (TNF), также относится к цитокинам с провоспалительной активностью. Выполняя те же функции, что и IL-1 и IL-6, он к тому же оказывает и цитотоксический эффект, способствуя разрушению тканей в местах поражения. Согласно результатам исследований, значительное число диффузно распространенных TNF-α-позитивных клеток при болезни Крона обнаруживается в собственной пластинке слизистой оболочки, в то время как при язвенном колите их присутствие отмечается в основном в субэпителиальном пространстве.
В изучении механизмов развития воспалительных заболеваний кишечника большое внимание в последние годы уделяется эйкозаноидам - физиологически активным продуктам метаболизма арахидоновой кислоты. К этим метаболитам относятся простагландины, тромбоксаны и лейкотриены.
Особый интерес к эйкозаноидам вызван тем, что повышение простагландинов, тромбоксанов и лейкотриенов почти всегда ассоциируется с воспалительной реакцией и сами они рассматриваются как медиаторы воспалительных заболеваний кишечника. Первоначально сообщалось о значительном повышении содержания простагландина E2 и лейкотриена B4 в тканях больных активными формами язвенного колита, участию этих медиаторов в процессе развития болезни Крона большого значения не придавалось. В дальнейшем повышенный синтез и секрецию эйкозаноидов стали находить при всех типах воспаления кишечника, включая болезнь Крона. При этом было отмечено, что повышенный синтез эйкозаноидов обнаруживается у пациентов с болезнью Крона даже при отсутствии у них стадии клинической активности процесса. Поскольку этим же свойством характеризовались и провоспалительные цитокины, был сделан вывод о патологически высоком уровне иммунной активности при болезни Крона. На основании полученных данных стали предприниматься попытки добиться снижения продукции эйкозаноидов при язвенном колите и болезни Крона назначением больным омега-жирных кислот, содержащихся в большом количестве в рыбьем жире. Эффект применения рыбьего жира оценивается как умеренный.
Ø Аутоиммунные процессы в развитии болезни Крона
В течение десятилетий дискутируется вопрос о том, является ли болезнь Крона истинным аутоиммунным заболеванием. Одна из ранних теорий основана на предположении, что интестинальное воспаление - следствие разрушения эпителия, вызванного аутоиммунной реакцией на антиген эпителия толстой кишки. В конце 50-х и начале 60-х годов прошлого века шведские исследователи идентифицировали аутоантитела к толстокишечным антигенам как при язвенном колите, так и при болезни Крона. Дальнейшие исследования, однако, показали, что антитела не были специфичными для этих заболеваний. Не удалось также обнаружить корреляции с активностью процесса в кишечнике и вызвать разрушение ткани в эксперименте на животных моделях с воспалительными заболеваниями толстой кишки.
Тем не менее концепция антитело-опосредованного аутоиммунитета недавно вновь возрождена. Ряд авторов описали циркулирующие и связанные с тканью антитела к специфическому протеину поверхности эпителиальной клетки толстой кишки.
Внекишечные проявления (например, артрит и перихолангит), часто наблюдаемые при болезни Крона, также наводят на мысль об аутоиммунной природе этого заболевания.
Роль интестинальной проницаемости в развитии болезни Крона
Кишечный эпителий служит барьером для прохождения бактериальных и других антигенов через слизистую оболочку, а нарушение целостности слизистой оболочки открывает доступ находящимся в просвете антигенам к субэпителиальным тканям. Рядом исследований показано, что проницаемость кишечника выше у пациентов с болезнью Крона, чем у больных язвенным колитом или у лиц контрольной группы. Обнаружена повышенная проницаемость у здоровых родственников пациентов с болезнью Крона, что позволило предположить, что данный дефект может быть генетически обусл