Урок по теме: «Соли азотной кислоты - Нитраты», 9 класс
Эпиграф к уроку: "Задача любой науки - предвидение и польза"
Д.И.Менделеев
План-конспект урока
Цель урока: Изучить свойства и значение нитратов.
I. Организационный момент.
II. Подготовка к восприятию нового материала.
У меня в руках большая морковь и свекла.
Вопрос:
· Ребята, это можно употреблять в пищу? (да, только помыть или почистить, и сварить).
Вопрос:
· А я скажу, не ешьте, отравитесь!
Почему они могут быть опасны для вашей жизни? (Наверно. Там яд!)
Вопрос:
· А какой может быть яд в овощах, выращенных на вашей даче? (В них могут содержаться нитраты!)
Вопрос:
· Что такое нитраты и откуда они там, мы выясним вместе!
Нитраты - Это соли азотной кислоты. А в овощах они появляются из удобрений.
Запишите тему нашего урока (мы по мере урока будем оформлять опорный конспект).
Цель нашего урока: изучить состав и свойства солей азотной кислоты, выяснить, где встречаются в природе и как используются человеком, узнать роль удобрений.
Достижение цели проведем по плану.
1. Определение.
2. Номенклатура нитратов.
3. Физические свойства.
4. Химические свойства.
5. Практическая работа на определение нитратов с солях и овощных соках
6. Применение.
7. Домашнее задание.
I I I. Изучение нового материала
1. Вопрос учителя:
Какие вещества называют солями? (это сложные вещества, состоящие из атома металла и кислотного остатка), а раз нитраты, значит, остаток азотной кислоты связан с атомом металла или ионом аммония.
Нитраты щелочных металлов, кальция и аммония – называют селитрами.
Не путайте, пожалуйста, нитраты с нитритами.
Нитриты – это соли азотистой кислоты – HNO2
Обратите внимание на плакат, где приведены названия и формулы важнейших нитратов. Особенность в названии:
NaNO3 – чилийская селитра
KNO3 – индийская селитра
Ca(NO3)2 – норвежская селитра
Как вы считаете, почему их так назвали? (потому, что основные залежи минералов – именно в этих местах).
Тривиальное название
Химическая формула
Систематическое название
Примечание
Аммонийная селитра
NH4NO3
Нитрат аммония
Бесцветное кристаллическое вещество, гигроскопичное, очень хорошо растворяющееся в воде с сильным понижением температуры раствора. Взрывается, особенно в смеси с металлическими порошками. Самое распространенное азотное удобрение.
Аммиачная селитра
Бариевая селитра
Ba(NO3)2
Нитрат бария
Бесцветные кристаллы. Окрашивает пламя в зеленый цвет. Используется как окислитель в пиротехнических составах цветного пламени.
Баритовая селитра
Калийная селитра
KNO3
Нитрат калия
Бесцветные кристаллы.
Индийская селитра
Магниевая селитра
Mg(NO3)2·H2O
Кристаллогидрат нитрата магния
Кальциевая селитра
Ca(NO3)2· 4·H2O
Кристаллогидрат нитрата кальция
Известковая селитра
Норвежская селитра
Чилийская селитра
NaNO3
Нитрат натрия
Обычно есть примеси галогенидов, основные месторождения в Чили (провинции Тарапака и Антофагаста). Цвет белый, желтоватый, красно-коричневый, серый. Твёрдость по шкале Мооса 1,5—2;. Плотность 2,3 г/см³. Образуется в основном за счёт вулканической деятельности или окисления азота. Гигроскопична.
Натронная селитра
Натриевая селитра
3. Физические свойства нитратов и нахождение в природе.
Прежде чем изучать свойства нитратов, необходимо познакомиться с правилами техники безопасности:
· все нитраты относятся к огневзрывоопасным веществам. Хранятся нитраты отдельно от органических и неорганических веществ.
Вопрос учителя:
Любые соли, по своему агрегатному состоянию, какие? (твердые кристаллические вещества).
(твердые, кристаллические белые вещества)
Итак, что запишем о физических свойствах? Записываем (твердые вещества хорошо растворимые в воде).
3. Химические свойства нитратов. Просмотр видео https://www.youtube.com/watch?v=jBi2XrMEOXo
Нитраты – это соли, а значит, для них характерны общие свойства солей.
Все нитраты – сильные электролиты, их растворы хорошо проводят электрический ток. Т. е., как и многие другие соли нитраты в водном растворе диссоциируют на ионы и вступают в реакции ионного обмена (например с со щелочами, кислотами или другими солями) (уравнения реакций в учебнике стр.56).
закончить уравнения реакций
Cu(NO3)2+ Fe ®
Fe(NO3)2+ NaOH®
Ba(NO3)2 + H2SO4®
Ag(NO3)2 + NaCl®
А теперь рассмотрим особенные свойства нитратов.Лабораторная работа №2 Температурный эффект при растворении.
Если взять два стакана: один с водойдругой с растворенной в ней селитрой,. С помощью термометра измерим температуру воды в начале в воде,а потом в растворе с селитрой – то увидим понижение температуры в растворе
Как вы думаете чем объясняется понижение температуры в растворе.
При растворении в воде нитратов наблюдается эндотермический эффект.(При растворении происходит поглощение энергии так как разрушается кристаллическая решетка) Это свойство нитратов можно использовать на даче, если этикетка отклеилась или потерялась, а мама по внешнему виду не может определить, что это за удобрение?
СУЩЕСТВУЕТ ИНТЕРЕСНАЯ ОСОБЕННОСТЬ, ЧЕМ ВЫШЕ ТЕМПЕРАТУРА ТЕМ ВЫШЕ РАСТВОРИМОСТЬ СОЛИ.
Растворимость солей в воде не только физический,но и химический процесс.
Какой процесс происходит при растворении в воде? Диссоциация. Давайте рассмотрим несколько примеров диссоциации солей.
Отсюда появляется другое определение нитратов – это электролиты, в водном растворе или расплаве при диссоциации которых образуются в качестве катионов – ионы металлов или ион аммония, а в качестве анионов – нитрат ионы).
2. Нитраты неустойчивы при нагревании.
Если насыпать селитры в пробирку и закрепить в штативе. Расплавить селитру KNO3 и бросить в нее кусочек раскаленного угля, он вспыхивает и сгорает.
Почему уголек сгорел? (тлеющая лучинка вспыхивает)
Какое вещество вызвало возгорание?
Так, если ваша Мама по внешнему виду не может определить, что это за удобрение, надо бросить на раскаленные угли щепотку кристаллов, если есть вспышки, т.е. выделяется кислород – это нитраты.
Кислород – поддерживает горение! А значит, при нагревании селитры образуется кислород.
Существует определенное правило, в зависимости от химической активности металла (его положения в электрохимическом ряду напряжений металлов), входящего в состав соли, разложение нитратов происходит по схеме (перенести схему в тетрадь):
Внимание, ребята, в схеме не отражена валентность металлов!
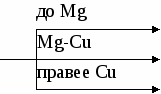
MeNO2 + O2
MeNO3 MeO + O2
Me + NO2 + O2
Как вы видите, ребята, выделяется не только кислород, но и ядовитый бурый газ (NO2)!
Рассмотрим это правило на примере разложения
KNO3, Cu(NO3)2, AgNO3, Hg(NO3)2., Ca(NO3)2, Zn(NO3)2
Кто хочет у доски разобрать пример?
1) 2KNO3 = 2KNO2 + O2
2) Ca(NO3)2 = Ca(NO2)2 + O2
3) 2Zn(NO3)2 = 2ZnO + 4NO2+ O2
4) 2Cu(NO3)2 = 2CuO + 4NO2+ O2
5) 2AgNO3 = 2Ag + 2NO2+ O2
6) Hg(NO3)2 = Hg + 2NO2+ O2
Однако, что касается нитрата аммония: NH4NO3= N2O + 2H2O
а нитрит аммония: NH4NO2= N2 + 2H2O
3. Качественная реакция на нитрат – ион.
Если в пробирку поместить немного селитры, добавить медных стружек, прилить концентрированную серную кислоту и нагреть: выделится газ бурого цвета, свидетельствующий о наличии нитрат - ионов
Слайд №10 NaNO3 + H2SO4 = NaHSO4 + HNO3
4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O
4. Применение.
1. Нитраты входят в состав горючих смесей. Нитрат калия входит в состав пороха в смеси с углем и серой.
2. Все селитры используются как минеральные азотные удобрения
3. Нитрат серебра используется для медицинских целей, в том числе ляписный карандаш.
Минеральные удобрения.
«Чтоб хорошо росли растения, нужна им пища удобрения». Азотные удобрения усиливают рост зеленой массы растения. Основателем агрохимии является Юстус Либих, немецкий химик, академик (1803-1873). Большая часть научных трудов Либиха касается вопросов агрохимии. Но Либих заложил также основы химии пищевых продуктов. Он родоначальник технологии производства мясного экстракта, дожившего до наших дней под именем «бульонных кубиков».
Следует отметить, что внесение удобрений должно быть дозировано согласно среде почвы, нельзя переусердствовать.
Дополнительная информация (прочесть)
Нитраты
Установлено, что нитраты и нитриты вызывают у человека метгемоглобинемию, рак желудка, отрицательно влияют на нервную и сердечно-сосудистую системы, на развитие эмбрионов. Метгемоглобинемия – это кислородное голодание, вызванное переходом гемоглобина крови в метгемоглобин, неспособный переносить кислород. Метгемоглобин образуется при поступлении нитритов в кровь. При содержании метгемоглобина в крови около 15% появляется вялость, сонливость, при содержании более 50% наступает смерть, похожая на смерть от удушья.
Зачем нужны азотные удобрения? Азот - очень важная составная часть живой материи: он входит в состав белков и аминокислот. Однако непосредственно из воздуха азот могут усваивать только особые бактерии, которые живут в клубеньках корешков бобовых растений (гороха, фасоли, клевера). Все другие растения потребляют только связанный азот в виде солей аммония или нитратов. Каждую осень человек собирает урожай, а значит, забирает азот из почвы, почва теряет свою плодородность и поэтому необходимо удобрять ее.
Для взрослого человека смертельная доза нитратов от 8 до 14 г, острое отравление наступает при приеме от 1 до 4 г нитратов.
Грунтовые воды содержат меньше нитратов, чем поверхностные, поскольку почва служит своего рода «фильтром». Чем глубже залегают грунтовые воды, тем меньше содержится в них нитратов.
Чтобы избежать образования нитритов, необходимо закладывать на хранение чистые сухие овощи без механических повреждений. На чистых овощах мало микроорганизмов, сухость ограничивает их перемещение, а отсутствие повреждений затрудняет получение ими питательных веществ.
Перед употреблением высоко нитратной пищи (капусты, огурцов, колбасы) можно принять аскорбиновую кислоту или выпить фруктовый сок, что предотвращает отравления нитратами.
Технология внесения удобрений для получения максимального урожая и длительного поддержания плодородия почвы сложна. Требуется оптимальное соотношение удобрений, их дозировка, сроки внесения, способ и место внесения, учет погодных условий. Передозировка азотных удобрений ведет к отравлению воды, флоры и фауны.
Все опасные последствия для человека, вызывают не сами нитраты, а их метаболиты – нитриты, восстанавливающиеся из нитратов воды и пищи, при хранении, кулинарной обработке, и в пищеварительном тракте человека под действием разнообразных микроорганизмов.
Содержание нитратов в рыбе и свежезамороженных продуктах не велико. Уровень нитратов в колбасных изделиях выше, чем в исходных продуктах, вследствие добавления нитратов в ходе изготовления колбас (нитраты придают соответствующую окраску колбасам, за рубежом – нитраты-консерванты).
К группе культур с довольно высокой способностью к накоплению нитратов относятся представители злаковых, крестоцветных, сложноцветных. В травах первых укосов - содержится в несколько раз больше нитратов, чем в последних, при условии, что непосредственно перед укосами не вносятся азотные удобрения.
Большой вред природным водам наносят растворенные в сточных водах минеральные удобрения, вымываемые из почвы и приносимые в водоем талыми или дождевыми водами. Удобрения вызывают бурное разрастание сорной травы и водорослей. Это приводит к зарастанию водоемов и их гибели. Чтобы предотвратить этот процесс разрабатывают производство минеральных удобрений в капсулах из пленки, обладающей свойствами мембраны. Это не толь предохраняет удобрение от вымывания, но и обеспечивает долговременное равномерное питание растений, сокращает расход удобрений.
При варке и тушении удаление нитрозоаминов с паром преобладает над их образованием, поэтому в процессе приготовления капусту, свеклу, кабачки не нужно закрывать крышкой.
Нитриты, соединяясь в желудочно-кишечном тракте с аминами и амидами, образуют канцерогенные нитрозосоединения, способные за 20-25 лет постоянного воздействия вызвать рак желудка.
Как выбрать малонитратные овощи? Они отличаются, прежде всего, размером: минимальное содержание нитратов чаще бывает в овощах среднего размера. Большинство мелких плодов – преимущественно молодые растения, для которых характерен избыток нитратов, как запас на будущее. Необычно крупные плоды – часто результат избыточного питания, в том числе и азотного.
Содержание нитратов снижается при чистке, вымачивании, отваривании. При чистке от растения отделяют и выбрасывают наиболее нитратные части: у капусты – кочерыжку, верхние листья и прожилки листьев, у огурца – заднюю (черешковую) часть и кожуру. При высоких содержаниях нитратов растения приобретают горьковатый привкус.
В снижении содержания нитратов в овощной продукции может помочь выбор оптимальных сроков уборки урожая. Так уборку листовых овощей следует проводить в вечерние часы, т.к. в это время в них содержится на 30-40% меньше нитратов.
В зависимости от способа приготовления пищи количество нитратов снижается неодинаково. При варке картофеля в воде уровень нитратов падает на 40-80%, на пару на 30-70%, при жарений в растительном масле на 15%, во фритюре на 60%. В отварной моркови кол-во нитратов снижается в 2 раза.
Для повышения урожайности с/х культур в почву вносят минеральные удобрения. Для полноценного питания и развития растений почва должна содержать достаточное кол-во азотных удобрений. Избыток азотных удобрений в почве приводит к накоплению нитратов в овощах и грунтовых водах.
В зимний период угроза отравления нитратами невелика, однако в весенне-летний период этот риск значительно возрастает.
И так с одной стороны нитраты хорошо усваиваются растениями, способствуют их росту и развитию, с другой стороны человеку избыток нитратов опасен для жизни.
Выводы из полученной информации
Возможные варианты ответов:
1. избегание растительной продукции.
2. отказ от азотных удобрений.
3. информированность о растениях – накопителях нитратов.
4. знание правил безопасности при использовании растительной продукции…..
Какой (-ие) более приемлемы?
Наличие избытка нитратов в растениях можно установить различными методами. Выпускается индикаторная бумага “Индам-2”, с помощью которой можно мгновенно определить избыток нитратов в растительной продукции. Однако ее не всегда встретишь в продаже. Можно использовать другую методику обнаружения нитратов.