Группа химия
Июня
1. Тема: Валентные возможности атомов химических элементов. Степень окисления.
Задание: Прочитать конспект. Ответить на вопросы: Вопросы для закрепления
1. Какими тремя факторами определяются валентные возможности атомов химических элементов?
2. Почему максимальная валентность атомов элементов второго периода не может быть больше четырех?
3. Вспомните, чем отличаются понятия валентности и степени окисления. Что между ними общего?
4. Укажите валентность и степень окисления атомов азота в ионе аммония NH4+
5. Определите валентность и степень окисления атомов углерода в веществах с формулами С2Н6, С2Н4, С2Н2, этиленгликоле, феноле.
6. Определите валентность и степень окисления атомов в веществах с формулами N2, NF3, Н2О2, ОF2, О2, F2, СО.
7. Определите валентные возможности атомов серы и хлора в основном и возбужденном состояниях
Конспект
Слово «валентность» (от лат. «valentia») возникло в середине XIX в., в период завершения химико-аналитического этапа развития химии. К тому времени было открыто более 60 элементов. Истоки понятия «валентность» содержатся в работах разных ученых. Дж.Дальтон установил, что вещества состоят из атомов, соединенных в определенных пропорциях. Э. Франкланд, собственно, и ввел понятие валентности как соединительной силы. Ф.А. Кекуле отождествлял валентность с химической связью. А.М.Бутлеров обратил внимание на то, что валентность связана с реакционной способностью атомов. Д.И.Менделеев создал периодическую систему химических элементов, в которой высшая валентность атомов совпадала с номером группы элемента в системе. Он же ввел понятие «переменная валентность».
Валентность – это количество ковалентных связей, которое образует атом в соединении с ковалентной связью.

| 
| Валентность азота равна III, т.к. азот образует три связи |
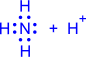
| 
| Валентность азота равна IV, т.к. азот образует четыре связи |
Валентность атома химического элемента не может быть выше полного числа орбиталей на внешнем уровне этого элемента.
| Азот | 7 N 1s22s22p3

| У атома азота на внешнем втором уровне 1s и 3p орбитали, всего 4 орбитали, следовательно, максимально возможная валентность равна IV |
| Фосфор |

| У атома фосфора в основном (стационарном) состоянии валентность как и у азота равна IV |
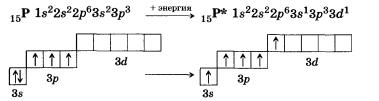
| У атома фосфора, в отличие от азота есть свободные d – орбитали, поэтому для фосфора характерно возбуждённое состояние, когда 3s2 электроны распариваются и валентность принимает значение V |
Наличие неподелённых электронных пар, способных переходить на свободные орбитали атома другого элемента (участвовать в образовании ковалентной связи по донорно-акцепторному механизму), расширяет валентные возможности атома.
Например, образование третьей связи при образовании иона гидроксония, неподелённая пара электронов атома кислорода (донор) переходит на свободную орбиталь иона водорода (акцептор):
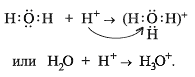

Вывод
Валентные возможности атомов химических элементов определяются:
1) числом неспаренных электронов (одноэлектронных орбиталей);
2) наличием свободных орбиталей;
3) наличием неподеленных пар электронов, способных переходить на свободные орбитали атома другого элемента (участвовать в образовании ковалентной связи по донорно-акцепторному механизму).
Июня
1. Тема: ПЗ и ПС химических элементов Д.И. Менделеева в свете учения о строении атома.
Задание: Прочитать конспект ответить на вопросы:
1. Сравните электронную конфигурацию атомов углерода и кремния. Какую валентность и степени окисления они могут проявлять в химических соединениях? Приведите формулы соединений этих элементов с водородом. Приведите формулы их соединений с кислородом в высшей степени окисления.
2. Напишите электронные формулы внешних оболочек следующих элементов: 14Si, 15P, 16S, 17Cl, 34Se, 52Te. Три элемента из этого ряда являются химическими аналогами (проявляют похожие химические свойства). Какие это элементы?
Урок: Периодический закон и периодическая система химических элементов Д.И. Менделеева
Предпосылки открытия периодического закона
В период становления науки химии ученые пытались привести в систему сведения об известных к тому времени нескольких десятков химических элементов. Эта проблема увлекла и Д.И. Менделеева. Он искал закономерности и взаимосвязи, которые бы охватывали все элементы, а не только часть из них. Менделеев считал важнейшей характеристикой элемента массу его атома. Проанализировав все известные к тому времени сведения о химических элементах и расположив их в порядке возрастания их атомных масс, в 1869 году он сформулировал периодический закон.
Формулировка закона: свойства химических элементов, простых веществ, а также состав и свойства соединений находятся в периодической зависимости от значения атомных масс.
К моменту формулировки периодического закона еще не было известно строение атома и существования элементарных частиц. Также впоследствии было установлено, что от атомных масс свойства вещества не зависят, как это предполагал Менделеев. Хотя, не обладая этими сведениями, Д. И. Менделеев не сделал в своей таблице ни единой ошибки.
После открытия Мозли, который установил экспериментально, что заряд ядра атома совпадает с порядковым номером химического элемента, указанным Менделеевым в его таблице, в формулировку его закона внесли изменения.
Описание периодической системы
Современная формулировка закона: свойства химических элементов, простых веществ, а также состав и свойства соединений находятся в периодической зависимости от значений зарядов ядер атомов.

Рис. 1. Графическим выражением периодического закона является Периодическая система химических элементов Д. И. Менделеева

Рис. 2. Рассмотрим принятые в ней обозначения на примере рубидия
В каждой ячейке, соответствующей элементу, представлены: химический символ, название, порядковый номер, соответствующий числу протонов в атоме, относительная атомная масса. Число электронов в атоме соответствует числу протонов. Количество нейтронов в атоме можно найти по разности между относительной атомной массой и количеством протонов, т. е. порядкового номера.
N(n0) = Ar - Z
Количество относительная порядковый
нейтронов атомная масса номер элемента
Например, для изотопа хлора 35Cl количество нейтронов равно: 35-17= 18
Составными частями периодической системы являются группы и периоды.
Периодическая система содержит восемь групп элементов. Каждая группа состоит их двух подгрупп: главной и побочной. Главные обозначены буквой а, а побочные – буквой б. Главная подгруппа содержит больше элементов, чем побочная. В главной подгруппе содержатся s- и p-элементы, в побочной – d-элементы.
Понятия о группах и периодах
Группа – столбец периодической системы, в котором объединены химические элементы, обладающие химическим сходством вследствие сходных электронных конфигураций валентного слоя. Это основополагающий принцип построения периодической системы. Рассмотрим это не примере элементов первых двух групп.
Табл. 1
| Элемент | Конфигурация валентных электронов | Элемент | Конфигурация валентных электронов |
| H | 1s1 | ||
| Li | 2s1 | Be | 2s2 |
| Na | 3s1 | Mg | 3s2 |
| K | 4s1 | Ca | 4s2 |
| Rb | 5s1 | Sr | 5s2 |
| Cs | 6s1 | Ba | 6s2 |
Из таблицы видно, что элементы первой группы главной подгруппы имеют один валентный электрон. Элементы второй группы главной подгруппы имеют два валентных электрона.
Некоторые главные подруппы имеют свои особенные названия:
Табл. 2
| I-a | Щелочные металлы |
| II-a | Щелочноземельные металлы |
| V-a | Пниктогены |
| VI-a | Халькогены |
| VII-a | Галогены |
| VIII-a | Благородные (инертные) газы |
Строка, называемая периодом, - это последовательность элементов, расположенных в порядке увеличения зарядов их ядер, которая начинается с щелочного металла (или водорода) и заканчивается благородным газом.
Номер периода равен количеству электронных уровней в атоме.
Существует два основных варианта представления периодической системы: длиннопериодный, в котором выделяют 18 групп (Рис. 3) и короткопериодный, в котором групп 8, но вводится понятие главной и побочной подгрупп (Рис. 1).

Рис. 3
Электронные конфигурации валентного слоя некоторых атомов
Периодическая повторяемость строения валентных электронов в атоме – это важнейший критерий, который объясняет и предсказывает свойства многих элементов. См. табл. 3.
Табл. 3
| Электронные конфигурации валентного слоя атомов элементов от лития до кальция | ||||||
| Элемент | Li | Be | B | C | N | O |
| Z | ||||||
| Электронная конфигурация | 2s1 | 2s2 | 2s22p1 | 2s22p2 | 2s22p3 | 2s22p4 |
| Элемент | F | Ne | Na | Mg | Al | Si |
| Z | ||||||
| Электронная конфигурация | 2s22p5 | 2s22p6 | 3s1 | 3s2 | 3s23p1 | 3s23p2 |
| Элемент | P | S | Cl | Ar | K | Ca |
| Z | ||||||
| Электронная конфигурация | 3s23p3 | 3s23p4 | 3s23p5 | 3s23p6 | 4s1 | 4s2 |
У каждой группы есть формула высшего оксида, т. е. оксида с максимальной степенью окисления элементов. Эта информация написана внизу таблицы. Например, для элементов V группы формула высшего оксида – R2O5. Это N2O5, P2O5, As2O5, V2O5…. По составу высшего оксида элемента можно определить его свойства. Оксиды состава R2O, RO основные. R2O3 - чаще всего амфотерные. Остальные оксиды – кислотные. Чем выше степень окисления элемента R, чем ярче выраженными кислотными свойствами обладает его оксид. Таким образом, кислотность высших оксидов элементов главных подгрупп увеличивается по периоду слева направо.
В таблице отражен состав летучих водородных соединений. Такие соединения образуют элементы IV-VII групп, причем только легких.