Тема: Насыщенный пар.
Цель урока: сформировать у учащихся научное, на основе молекулярно-кинетической теории, представление о влажности воздуха.
Задачи урока:
- образовательные: дать понятие насыщенного и ненасыщенного пара, кипения, влажности воздуха, точки росы; опытным путем определить зависимость давления насыщенного пара от температуры; формировать навыки техники экспериментального определения влажности воздуха с помощью психрометра; ознакомить учащихся с принципом действия приборов для определения влажности воздуха;
- развивающие: развивать творческие способности, логическое мышление, внимание, память;
- воспитательные: воспитание самостоятельности, умения сотрудничать при работе в группах.
Тип урока: урок моделирования учений и навыков.
Оборудование урока: таблицы, психрометр, гигрометры, компьютер, листы А4, фломастеры, видеоматериал.
ХОД УРОКА
І. Организационный момент
Учитель. Ребята, природа, которая нас окружает, очень разнообразна. И сегодня снежинки на уроке окрасились в разные цвета. Выберите себе понравившуюся снежинку.
(Учащиеся выбирают снежинки разных цветов – этот цвет определяет группу, в какой ребенок будет работать).

ІІ. Определение цели и задач урока
Учитель. Снежинки не зря к нам сегодня прилетели. Они предлагают каждой группе ассоциации к таким словам: группа синих снежинок – слово вода, группа сиреневых снежинок – слово воздух, группа фиолетовых снежинок – слово дождь, группа зеленых снежинок – слово снег, група коричневых снежинок – слово чайник. (Учащиеся систавляют ассоциативные кусты и записывают их на листах бамаги. После этого обсуждаются возникшые ассоциации и определяются цель, задачи урока (слайды 1, 2).
ІІІ. Актуализация опорных знаний
На данном уроке, тема которого: «Насыщенный пар. Кипение», мы рассмотрим основные свойства насыщенного пара, а также познакомимся с таким процессом, как кипение.
Из курса физики 8 класса вам хорошо известно, что такое агрегатное состояние вещества. Кроме того, вы хорошо знаете, каким образом вещество может переходить из одного состояния в другое. В частности, вы знаете, что, если жидкость превращается в пар, такой процесс называется парообразованием, обратный же процесс, переход из пара в жидкость, называется конденсацией. Схема таких преобразований представлена на рисунке 1.

Рис. 1. Схема изменения агрегатного состояния вещества
Парообразование – свойство капельных жидкостей заменять свое агрегатное состояние и превращаться в пар.
Из материала 8 класса мы знаем, что парообразование делится на два вида:
1. Испарение, которое происходит с поверхности раздела жидкости и окружающего воздуха;
2. Кипение, которое происходит во всем объеме жидкости при определенных условиях.
Теперь рассмотрим эти процессы более серьезно, имея на вооружении знания, которые мы получили в разделе «Молекулярно-кинетическая теория».
Насыщенный пар
Давайте задумаемся над таким вопросом. Как мы знаем, все молекулы жидкости находятся в состоянии непрерывного хаотического движения. Хаотичность, в частности, означает, что направление движения отдельных молекул носит случайный характер. Почему же при этом жидкость сохраняет свой объем, а не распадается на отдельные частицы? Между молекулами действуют силы притяжения, которые не позволяют им покинуть жидкость. Кроме того, очевидно, что значение скоростей молекул также случайны, а следовательно, среди них обязательно найдутся очень быстрые молекулы. Если такая молекула вследствие хаотического перемещения окажется вблизи поверхности раздела жидкости и окружающего воздуха, то ее кинетической энергии может хватить на то, чтобы преодолеть силы притяжения и вырваться наружу (см. рис. 2).


Рис. 3. Процессы испарения и конденсации в закрытой системе (сосуде)
Рис. 2. Наглядное изображение поведения молекул в жидкости
Это и есть упомянутый выше процесс испарения. Когда количество испарившихся молекул становится значительным, они образуют пар. Конечно, может произойти и обратное. Вырвавшиеся за пределы жидкости молекулы вследствие хаотического движения снова вернутся в объем жидкости, такой процесс, как мы знаем, называется конденсацией. Если сосуд с жидкостью будет открыт, то испарившиеся молекулы могут безвозвратно покидать пространство над жидкостью, в результате чего количество последней будет постепенно уменьшаться. Примеры описанного мы можем повсеместно наблюдать вокруг, все процессы высыхания именно так и происходят – жидкость испаряется, а пар обратно не конденсируется вследствие того, что молекулы этого пара удаляются от жидкости.
Проделайте дома очень простой эксперимент: наполните стакан водой и проследите за уровнем воды в течение нескольких дней. Через несколько дней вы увидите, что уровень воды стал значительно ниже, вода испарялась.
Разные жидкости испаряются с разными скоростями. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии их преодолеть и вылететь наружу и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее – вода. Намного медленнее воды испаряются масло и ртуть.
Поскольку испарение – это уход из жидкости самых быстрых молекул, то средняя кинетическая энергия молекул, которые остались в жидкости, естественно уменьшается.
А что такое средняя кинетическая энергия молекул? Это, фактически, температура, т. е. жидкость при испарении остывает. Вам хорошо знакомо ощущение прохлады и порой даже зябкости, особенно при ветре, когда выходишь из воды. Вода, испаряясь по всей поверхности тела, уносит тепло. Ветер же ускоряет процесс испарения.
А что будет, если мы закроем сосуд с жидкостью? Молекулы пара уже не смогут покидать пространство над ней, по мере испарения их количество сначала будет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
Т. е. в такой системе будут идти два конкурирующих процесса (см. рис. 3).
Первый – это процесс испарения, для которого количество покидающих жидкость молекул будет определяться только температурой. Почему? Смотрите ответвление № 1.
Работа выхода
Попробуем разобраться, какими параметрами определяется скорость испарения жидкости, от чего она зависит. Чтобы вырваться из объема жидкости, молекула должна преодолеть притяжение со стороны других молекул той же жидкости. Другими словами, ей необходимо совершить работу против сил межмолекулярного взаимодействия. Величина этой работы зависит от рода жидкости и носит название работы выхода. Таким образом, в парообразное состояние могут перейти те молекулы, чья кинетическая энергия превосходит значение работы выхода, это отражено в формуле:
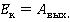
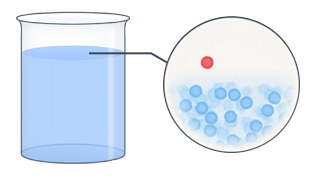
Рис. 4. Процесс испарения (процесс вылета молекулы с поверхности жидкости)
Долю молекул, удовлетворяющих этому условию, можно оценить, зная, так называемое, распределение молекул по скоростям, т. е. долю от общего числа молекул, обладающих данным значением скорости, а значит, и кинетической энергией.
Изучением таких распределений занимается раздел физики, который называется статистическая физика, однако ввиду его математической сложности в курс физики школы он не включен.
В 8 классе вы называли основные факторы, которые повлияют на скорость испарения. Итак, от чего же будет фактически зависеть количество молекул, которые убежали из жидкости? Эти факторы:
1. Род жидкости
2. Температура жидкости
3. Скорость отвода испарившихся молекул от жидкости (вспомните: для того чтобы остудить чай, мы дуем)
4. Площадь поверхности жидкости
На примере с чаем: для того чтобы он остывал быстрее, мы наливаем его в блюдце.
Итак, мы обсудили, какой же параметр характеризует способность молекул той или иной жидкости испаряться – это работа выхода – и какие факторы влияют на скорость испарения.
А второй процесс – это процесс конденсации, в котором количество возвращающихся в жидкость молекул будет, помимо прочего, зависеть и от концентрации молекул пара: чем больше молекул пара, тем большая вероятность, что одна из них вернется в жидкость.
Конспект: Испарение – это процесс парообразования, который протекает с поверхности жидкости при любой температуре.
Конденсация – это процесс превращения пара в жидкость.
От рода жидкости, температуры, площади поверхности жидкости, от ветра.
Вначале, пока эта концентрация невелика, количество конденсирующихся молекул за единицу времени будет, естественно, меньше количества испаряющихся молекул, т. е. молекул, покидающих жидкость. Однако по мере роста концентрации пара поток молекул пар – жидкость будет расти, а обратный поток будет оставаться прежним, ведь он определяется только температурой.
В какой-то момент оба количества молекул станут равными. Как говорят физики, в системе установится динамическое равновесие, а пар достигнет состояния, так называемого, насыщения. Соответственно, пар, который находится в состоянии динамического равновесия со своей жидкостью, мы будем называть насыщенным.
Представьте себе здание с огромным количеством дверей. Какое-то количество людей заходит в это здание, а какое-то количество людей выходит из этого здания. Если количество людей, которые входят в здание, равно количеству людей, которые выходят из здания в единицу времени, то можно сказать, что достигнуто состояние насыщения. Вот точно так же происходит и в случае с паром.
Насыщенный пар – это в некотором смысле предельное состояние пара. Имеется в виду, что значение давления этого пара и его плотности являются максимальными при данном значении температуры. В противном же случае мы будем называть пар ненасыщенным.
До сих пор газообразное состояние мы обсуждали лишь на примере идеального газа, тем более удивительным является тот факт, что некоторые уравнения, которые описывают идеальный газ, вполне подходят и для состояния насыщенного пара.
Оказывается, что состояние насыщенного пара хоть и приближенно, но вполне удовлетворительно описывается уравнением Менделеева – Клапейрона:

Здесь индекс Н указывает на то, что данные параметры относятся к насыщенному пару, µ – это молярная масса пара.
ІV. Изучение нового материала
Рассмотрим теперь, что происходит в закрытом сосуде при постоянной температуре. Сначала жидкость начнет испаряться, но, спустя некоторое время, пар начнет конденсироваться. Поскольку объём сосуда остаётся неизменным, чем больше молекул покидает жидкость, тем больше становится плотность пара в сосуде. Но, вместе с этим, все больше молекул имеют шанс вернуться обратно в жидкость. При неизменной температуре в сосуде, в конце концов, количество молекул, покидающих жидкость, станет равно количеству молекул, возвращающихся обратно. Такое состояние называется динамическим равновесием.
Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным паром. То есть, если пар является насыщенным, то в данном объёме, при данной температуре не может находиться большее количество пара.
Если сжать насыщенный пар при постоянной температуре, то динамическое равновесие нарушиться. Количество молекул, переходящих из газа в жидкость будет превышать количество молекул, переходящих из жидкости в газ до тех пор, пока в сосуде снова не установится динамическое равновесие. Обратите внимание на несколько важных пунктов: из определения насыщенного пара следует, что его плотность строго определена для данной жидкости. Поэтому, концентрация насыщенного пара остается постоянной при динамическом равновесии, независимо от объёма.
А теперь, вспомним связь между давлением, концентрацией и температурой:

Мы только что выяснили, что концентрация остается постоянной, и мы рассматривали процесс при постоянной температуре. Поскольку коэффициент k — это постоянная Больцмана, которая является константой, делаем вывод, что давление насыщенного пара не зависит от занимаемого им объёма.
На первый взгляд может показаться, что это противоречит одному из газовых законов: при постоянной температуре давление остается постоянным, несмотря на то, что объём уменьшается. Никакого противоречия здесь нет: дело в том, что газовые законы применимы к газу постоянной массы, а масса насыщенного пара меняется при сжатии, поскольку часть его молекул переходит в жидкость. Тем не менее, состояние насыщенного пара достаточно точно описывается уравнением Менделеева-Клапейрона, хотя насыщенный пар, строго говоря, не является идеальным газом.
Не трудно догадаться, что ненасыщенный пар — это пар, который не находится в динамическом равновесии со своей жидкостью. Или ненасыщенным паром можно называть такой пар, который при сжатии при постоянной температуре не превращается в жидкость. Тем не менее, если продолжать сжимать пар, то в какой-то момент, он все же станет насыщенным, и начнет превращаться в жидкость при дальнейшем сжатии. Следует отметить, что пар превращается в жидкость не при любой температуре, а только если температура ниже определённого значения. Такая температура называется критической.
Итак, если температура вещества выше критической, то его состояние называют газом.