Тема: «Медь и её соединения»
Медь (купрум, свое название получила в честь острова Кипр, где было открытое крупное медное месторождение) является одним из первых металлов, который освоил человек - Медный век (эпоха, когда в обиходе человека преобладали медные орудия) охватывает период IV—III тысячелетия до н. э.
Сплав меди с оловом (бронза) был получен на Ближнем Востоке за 3000 лет до н. э. Бронза была предпочтительней меди, поскольку была более прочна и лучше поддавалась ковке.
Среднее содержание меди в земной коре составляет 4,7-5,5·10-3% по массе. Медь присутствует в природе, как в виде самородков, так и в соединений, наибольшее промышленное значение из которых имеют медный колчедан (CuFeS2), халькозин Cu2S и борнит Cu5FeS4. Разработка медных месторождений ведется открытым способом.
Медь в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером "29", относится к переходным металлам (См. Атомы переходных элементов).
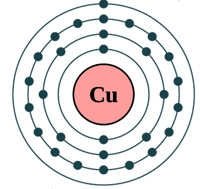
Рис. Строение атома меди.
Электронная конфигурация атома меди - 1s22s22p63s23p63d104s1 (см. Электронная структура атомов). У меди один спаренный электрон с внешнего s-уровня "перескакивает" на d-подуровень предвнешней орбитали, что связано с высокой устойчивостью полностью заполненного d-уровня. Завершенный устойчивый d-подуровень меди обусловливает ее относительную химическую инертность (медь не реагирует с водородом, азотом, углеродом, кремнием). Медь в соединениях может проявлять степени окисления +3, +2, +1 (наиболее устойчивые +1 и +2).
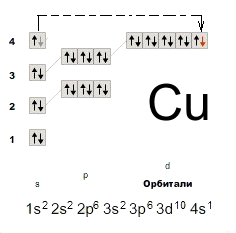
Рис. Электронная конфигурация меди.
Физические свойства меди:
· металл, красно-розового цвета;
· обладает высокой ковкостью и пластичностью;
· хорошей электропроводностью;
· малым электрическим сопротивлением.
Химические свойства меди
· при нагревании реагирует с кислородом:
O2 + 2Cu = 2CuO;
· при длительном пребывании на воздухе реагирует с кислородом даже при комнатной температуре:
O2 + 2Cu + CO2 + H2O = Cu(OH)2·CuCO3;
· вступает в реакции с азотной и концентрированной серной кислотой:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O;
· с водой, растворами щелочей, соляной и разбавленной серной кислотой медь не реагирует.
Соединения меди
Оксид меди CuO (II):
· твердое вещество красно-коричневого цвета, не растворимое в воде, проявляет основные свойства;
· при нагревании в присутствии восстановителей дает свободную медь:
CuO + H2 = Cu + H2O;
· оксид меди получают взаимодействием меди с кислородом или разложением гидроксида меди (II):
O2 + 2Cu = 2CuO; Cu(OH)2 = CuO + H2O.
Гидроксид меди Cu(OH2)(II):
· кристаллическое или аморфное вещество голубого цвета, нерастворимое в воде;
· разлагается на воду и оксид меди при нагревании;
· реагирует с кислотами, образуя соответствующие соли:
Cu(OH2) + H2SO4 = CuSO4 + 2H2O;
· реагирует с растворами щелочей, образуя купраты - комплексные сооединения ярко-синего цвета:
Cu(OH2) + 2KOH = K2[Cu(OH)4].
Более подробно о соединениях меди см. Оксиды меди.
Получение и применение меди
· пирометаллургическим методом медь получают из сульфидных руд при высоких температурах:
CuFeS2 + O2 + SiO2 → Cu + FeSiO3 + SO2;
· оксид меди восстанавливается до металлической меди водородом, угарным газом, активными металлами:
Cu2O + H2 = 2Cu + H2O;
Cu2O + CO = 2Cu + CO2;
Cu2O + Mg = 2Cu + MgO.
Применение меди обусловливается ее высокой электро- и теплопроводностью, а также пластичностью:
· изготовление электрических проводов и кабелей;
· в теплообменной аппаратуре;
· в металлургии для получения сплавов: бронзы, латуни, мельхиора;
· в радиоэлектронике.
Источники: https://prosto-o-slognom.ru/chimia/511_med_Cu.html