Ионными называют решётки, в узлах которых находятся ионы.
Их образуют вещества с ионной связью. В узлах такой решётки располагаются положительные и отрицательные ионы, связанные между собой электростатическим взаимодействием.
Ионные кристаллические решётки имеют соли, щёлочи, оксиды активных металлов.
Ионы могут быть простые или сложные. Например, в узлах кристаллической решётки хлорида натрия находятся простые ионы натрия Na+ и хлора Cl−, а в узлах решётки сульфата калия чередуются простые ионы калия K+ и сложные сульфат-ионы SO2−4.
Связи между ионами в таких кристаллах прочные. Поэтому ионные вещества твёрдые, тугоплавкие, нелетучие. Такие вещества хорошо растворяются в воде.

Рис. 1. Кристаллическая решётка хлорида натрия

Рис. 2. Кристаллы хлорида натрия
Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов.
Их образуют вещества с металлической связью. В узлах металлической решётки находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы, отдавая свои внешние электроны в общее пользование).
Такие кристаллические решётки характерны для простых веществ металлов и сплавов.
Температуры плавления металлов могут быть разными (от –37 °С у ртути до двух-трёх тысяч градусов). Но все металлы имеют характерный металлический блеск, ковкость, пластичность, хорошо проводят электрический ток и тепло.

Рис. 3. Металлическая кристаллическая решётка

Рис. 4. Изделие из металла
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, соединённые ковалентными связями.
Такой тип решётки имеет алмаз — одно из аллотропных видоизменений углерода. К веществам с атомной кристаллической решёткой относятся графит, кремний, бор и германий, а также сложные вещества, например, карборунд SiC и кремнезём, кварц, горный хрусталь, песок, в состав которых входит оксид кремния(IV) SiO2.
Таким веществам характерны высокая прочность и твёрдость. Так, алмаз является самым твёрдым природным веществом.
У веществ с атомной кристаллической решёткой очень высокие температуры плавления и кипения. Например, температура плавления кремнезёма — 1728 °С, а у графита она выше — 4000 °С.
Атомные кристаллы практически нерастворимы.
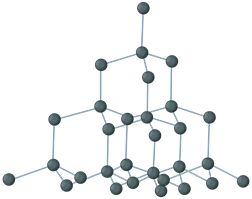
Рис. 5. Кристаллическая решётка алмаза

Рис. 6. Алмаз
Молекулярными называют решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием.
Несмотря на то, что внутри молекул атомы соединены очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому молекулярные кристаллы имеют небольшую прочность и твёрдость, низкие температуры плавления и кипения.
Многие молекулярные вещества при комнатной температуре представляют собой жидкости и газы. Молекулярная кристаллическая решётка характерна для благородных газов, водорода, азота, кислорода, иода, белого фосфора, воды, «сухого льда», большинства органических веществ.
Такие вещества летучи. Например, кристаллические иод и твёрдый оксид углерода(IV) («сухой лёд») испаряются, не переходя в жидкое состояние.
Некоторые молекулярные вещества имеют запах.
Такой тип решётки имеют простые вещества в твёрдом агрегатном состоянии: благородные газы с одноатомными молекулами (He,Ne,Ar,Kr,Xe,Rn), а также неметаллы с двух- и многоатомными молекулами (H2,O2,N2,Cl2,I2,O3,P4,S8).
Молекулярную кристаллическую решётку имеют также вещества с ковалентными полярными связями: вода — лёд, иод, твёрдые аммиак, кислоты, оксиды большинства неметаллов. Большинство органических соединений тоже представляют собой молекулярные кристаллы (нафталин, сахар, глюкоза).


Рис. 7. Кристаллическая решётка иода Рис. 8. Иод
Таблица Типы кристаллических решёток
| Тип кристаллической решетки | Вид частицы в узлах решётки | Характер сил взаимодействия частиц | Характерные физические свойства веществ | Примеры веществ |
Молекулярная

| Молекулы | Слабое межмолекулярное взаимодействие | Низкоплавкие вещества (газы, жидкости или легкоплавкие твёрдые тела при комнатной температуре), летучие, часто имеют запах | Благородные газы, водород, азот, кислород, иод, белый фосфор, вода, «сухой лёд», большинство органических веществ |
Атомная
| Атомы | Прочные ковалентные связи | Тугоплавкие, нерастворимые в воде, твёрдые, не проводят электрический ток даже в расплаве | Алмаз, графит (), кремний, бор, кварц, карборунд, нитрид бора |
Ионная

| Ионы | Прочные ионные связи | Тугоплавкие, хрупкие, иногда растворимы в воде, в твёрдом виде не проводят электрический ток, а в растворе и расплаве проводят | Соли, щёлочи, оксиды большинства металлов |
Металлическая
| Катионы металлов | Металлическая связь между катионами металлов и свободными электронами | Пластичные, ковкие, обладают металлическим блеском, высокой тепло- и электропроводностью | Металлы и сплавы |
Некоторые вещества могут находиться как в кристаллическом, так и в аморфном состояниях, например сера, оксид кремния() и некоторые другие.
 Коротко о главном
Коротко о главном
Твёрдые вещества могут иметь кристаллическое и аморфное строение. Для кристаллических веществ характерно упорядоченное расположение образующих их частиц, для аморфных — хаотичное.
Кристаллические вещества образуют четыре типа кристаллических решёток: молекулярную, атомную, ионную и металлическую.