МЕТОДИЧЕСКИЕ УКАЗАНИЯ
и контрольные задания к контрольной работе
для студентов заочного отделения
| Специальность: | 18.02.06 Химическая технология органических веществ |
Новочебоксарск 2015
| «СОГЛАСОВАНО» Представители работодателя _________________ ______/__________/ Наименование организации, подпись должность Заместитель директора по УР _______________ Т.Н.Кузьмина | «УТВЕРЖДАЮ» Директор техникума _______________ Е.Ю. Пристова «____»______________ 20___ г. |
| Рассмотрено на заседании ПЦК химической технологии и машиностроения Протокол №__ от _____________________ Председатель _____________В.А. Павлова |
| Автор: | Павлова В.А., преподаватель Новочебоксарского химико-механического техникума Минобразования Чувашии |
© Новочебоксарский химико-механический техникум Минобразования Чувашии 2015
Пояснительная записка
Учебный план по профессиональному модулю ПМ.04 «Планирование и организация работы персонала структурного подразделения», предусматривает изучение данной дисциплины в течение 8 семестра. В процессе обучения выполняется одна домашняя контрольная работа, а так же предусмотрен квалификационный экзамен. Учебным планом предусматривается часов на установочные лекции и практические занятия. Основную часть работы студент выполняет в течение семестра самостоятельно.
В данном методическом пособии приводятся задания для контрольной работы и методические указания по ее выполнению.
Выполненную работу студент сдает на проверку в секретариат заочного отделения.
К сдаче экзамена студент допускается только при наличии зачетной контрольной работы.
В результате освоения профессионального модуля ПМ.04 «Планирование и организация работы персонала структурного подразделения» согласно требованиям ФГОС СПО по специальности 18.02.06 «Химическая технология органических веществ» студенты должны:
иметь практический опыт:
· планирования, координирования и обеспечения работы персонала структурного подразделения на выполнение производственных заданий в соответствии с требованиями промышленной и экологической безопасности;
уметь:
· организовать эффективную работу первичного производственного коллектива, используя современный менеджмент и принципы делового общения;
· применять передовые методы и приемы работы;
· морально и психологически настраивать коллектив исполнителей на трудовую деятельность;
· обучать и контролировать соблюдение персоналом требований охраны труда и экологической безопасности;
· проводить анализ причин травматизма и принимать меры по их устранению;
· обеспечивать, контролировать ведение оперативных журналов;
· владеть программным обеспечением;
· оформлять технологическую и другую техническую документацию в соответствии с действующей нормативной базой;
знать:
· инструкции о порядке приема, сдачи смены и организации рабочего места;
· основы современного менеджмента;
· принципы делового общения;
· систему управления охраны труда в организации;
· нормы, правила и инструкции по безопасной организации труда персонала;
· виды нормативно-технической, цеховой документации;
· правила заполнения оперативных журналов;
- основы компьютерной грамотности.
Требования к оформлению и содержанию контрольной работы
Вариант задания студент выбирает по номеру в журнале.
При выполнении контрольной работы следует соблюдать следующие требования:
1. Ответы на вопросы должны быть четкими и полными.
2. Контрольная работа выполняется в тетради школьного формата в объеме 12-14 страниц рукописной записи.
3. Отвечать на вопросы контрольных работ необходимо в той последовательности, в которой они заданы. Номер задания контрольной работы определяется студентами по его порядковому номеру в журнале.
4. Каждый вопрос и ответ на него должны начинаться с новой страницы. Страницы должны быть пронумерованы.
Контрольная работа должна содержать:
1. Титульный лист.
2. Вопросы с ответами на них, задания с решением.
3. Задание для практической части работы.
4. Распечатку каждого практического задания на отдельной странице с соответствующим заголовком.
5. Список использованной литературы.
6. Компьютерный носитель с файлами созданных документов.
Задания к контрольной работе
Теоретическая часть
Изучите теоретический материал. Напишите краткие конспекты ответов на два вопроса для своего варианта. Подготовьтесь к сдаче экзамена.
1. Методология проектирования химических производств.
2. Предпроектирование химических производств. Определение мощности проектируемого производства.
3. Выбор метода (технологии) производства.
4. Эскизная технологическая схема.
5. Расчет материальных и тепловых балансов по стадиям производства.
6. Проектирование химических производств.
7. Общие принципы анализа, расчета и выбора технологического оборудования.
8. Расчет нестандартного оборудования. Расчет на прочность элементов оборудования.
9. Разработка принципиальной технологической схемы.
10. Компоновка производства.
11. Основы промышленной безопасности в составе проектной документации.
12. Разработка декларации промышленной безопасности.
13. Основы разработки плана локализации и ликвидации последствий аварий.
14. Экологическая безопасность проектируемого производства.
15. Рабочая документация.
16. Общая характеристика и основные понятия процесса интегрированного проектирования ХТС.
17. Средства и методы интегрированного проектирования ХТС.
18. Методология интегрированного проектирования ХТС.
19. Управление персоналом интегрированного проектирования.
20. Аппаратурно-технологическое оформление автоматизированных химических производств.
21. Основные понятия и определения многоассортиментных ХТС.
22. Основные подходы к анализу и синтезу многоассортиментных ХТС.
23. Моделирование многоассортиментных ХТС.
Таблица 1 – Вопросы для письменного ответа
| Вариант | ||||||||||
| Номера вопросов | ||||||||||
| Вариант | ||||||||||
| Номера вопросов | ||||||||||
Практическая часть
Задание 2.
Рассмотрите схему перемещения жидкости сжатым газом (рис. 1).
 Рисунок 1 – Схема транспортирования
жидкости сжатым газом.
Рисунок 1 – Схема транспортирования
жидкости сжатым газом.
| В расходную емкость Е1 подают сжатый газ (воздух, а при транспортировке легковоспламеняющихся жидкостей – азот) с избыточным давлением Р изб. Под действием давления жидкость из емкости Е1 поднимается на высоту Н и сливается в приемную емкость Е2. При полном опорожнении расходной емкости сжатый газ может «прорываться» в приемную емкость. Этот газ проходит через каплеуловитель Е3. Уловленную жидкость из каплеуловителя Е3 самотеком сливают в приемную емкость Е2. |
В расходной емкости пары жидкости смешиваются со сжатым газом и образуют парогазовую смесь (ПГС). Парциальное паров летучего вещества в ПГС вычисляют по уравнению
 (а),
(а),  (б), (1)
(б), (1)
где Р S – общее абсолютное давление; уi – мольноя доля вещества в ПГС; j – степень насыщения; Рi o – давление насыщенных паров; хi – мольноя доля вещества в жидкости; g i – коэффициент активности.
Коэффициент насыщения j зависит от длительности процесса, конструкции аппарата, его значение может изменяться от 0 до 1.
Для чистых жидкостей произведение 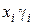 =1,0.
=1,0.
Давление насыщенных паров над чистой жидкостью вычисляют, как правило, по уравнению Антуана
 . (2)
. (2)
Плотность идеальных газов вычисляют по уравнению Клапейрона, кг/м3
 , (3)
, (3)
где М – мольная масса газа, кг/кмоль; R m = 8314 Дж/(кмоль×К) – универсальная газовая постоянная; Р – давление абсолютное, Па; Р 0 =101325 Па (760 мм рт. ст.) – нормальное давление; Т – абсолютная температура, К; Т 0 = 273,15 К – нормальная температура; 22,4 – мольный объем идеального газа при нормальных условиях, м3/кмоль.
Абсолютное давление вычисляют по уравнению
 , (4)
, (4)
где В – барометрическое давление, В ≈ 100 кПа = 750 мм рт. ст.
Задача 2.1. Рассчитайте массу паров жидкости и азота в парогазовой смеси (ПГС) в расходной емкости. Исходные данные: объем ПГС составляет V м3; температура жидкости и ПГС равна t оС; В расходной емкости поддерживают избыточное давление Р изб. Использовать модель идеальных газов.
Исходные данные приведены в таблице 2. Коэффициенты уравнения Антуана даны в таблице 3.
Таблица 2 – Исходные данные для задачи 2.1
| Вари-ант | Наименование транспортируемой жидкости | Объем ПГС, V м3 | Температура жидкости и ПГС, t оС | Избыточное давление, Р изб., кПа | Степень насыщения ПГС парами j |
| н -Пентан | 0,91 | ||||
| н -Гексан | 0,86 | ||||
| н -Гептан | 0,81 | ||||
| н -Октан | 0,76 | ||||
| Бензол | 0,71 | ||||
| Толуол | 0,66 | ||||
| о -Ксилол | 0,61 | ||||
| Метанол | 0,56 | ||||
| Этанол | 0,46 | ||||
| Изопропанол | 0,41 | ||||
| н -Бутанол | 0,36 | ||||
| Ацетон | 0,93 | ||||
| Диэтиловый эфир | 0,87 | ||||
| Этилацетат | 0,82 | ||||
| Изобутилацетат | 0,77 | ||||
| Дихлорметан | 0,72 | ||||
| Трихлорметан | 0,67 | ||||
| 1,2-Дихлорэтан | 0,62 | ||||
| Трихлорэтилен | 0,57 | ||||
| Тетрахлорэтилен | 0,52 |
Последовательность расчета
1. Абсолютная температура ПГС, К Т ≈ 273 + t
2. Общее абсолютное давление ПГС по уравнению (4), Па
3. Давление насыщенных паров вещества по уравнению (2), мм рт. ст.
4. Парциальное давление паров вещества в ПГС по уравнению (1б), Па
5. Объемная (мольная) доля паров вещества в ПГС по уравнению (1а),
 (5)
(5)
6. Плотность паров вещества в ПГС по уравнению (3), кг/м3
7. Масса паров вещества в ПГС, кг mi =r iV
8. Парциальное давление азота в ПГС, Па 
9. Плотность азота в ПГС по уравнению (3), кг/м3
10. Масса азота в ПГС, кг
Таблица 2 – Значения коэффициентов уравнения Антуана для расчета давления насыщенных паров над жидкостью или температуры кипения [13], 1 мм рт. ст. = 133,3 Па
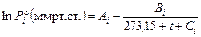

| Вещество | Формула | М, кг/кмоль | А | В | С | Интервал температур, оС | Температура кипения при 760 мм Hg, оС | Номер в [13] (прил. А) | |
| Предельные углеводороды | |||||||||
| н -Пентан | C5H12 | 72,151 | 15,8333 | 2477,07 | -39,94 | -53 … +57 | 36,0 | ||
| н -Гексан | C6H14 | 86,178 | 15,8366 | 2697,55 | -48,78 | -28...+97 | 68,7 | ||
| н -Гептан | C7H16 | 100,205 | 15,8737 | 2911,32 | -56,51 | -3 …+127 | 98,5 | ||
| н -Октан | C8H18 | 114,232 | 15,9426 | 3120,29 | -63,63 | +19. +152 | 125,6 | ||
| Ароматические углеводороды | |||||||||
| Бензол | C6H6 | 78,114 | 15,9008 | 2788,51 | -52,36 | +7 …+104 | 80,1 | ||
| Толуол | C7H8 | 92,141 | 16,0137 | 3096,52 | -53,67 | +7 … +137 | 110,6 | ||
| о -Ксилол | C8H10 | 106,168 | 16,1156 | 3395,57 | -59,46 | +32 … +172 | 144,5 | ||
| м -Ксилол | C8H10 | 106,168 | 16,1390 | 3366,99 | -58,04 | +27 … +167 | 139,2 | ||
| п -Ксилол | C8H10 | 106,168 | 16,0963 | 3346,65 | -57,84 | +27 … +167 | 138,4 | ||
| Хлорбензол | C6H5Cl | 112,559 | 16,0676 | 3295,12 | -55,60 | +47 … +147 | 131,8 | ||
| Спирты и органические кислоты | |||||||||
| Метанол | CH4O | 32,042 | 18,5875 | 3626,55 | -34,29 | -16 … +91 | 64,6 | ||
| Этанол | C2H6O | 46,069 | 18,9119 | 3803,98 | -41,68 | -3 … +96 | 78,4 | ||
| Изопропанол | C3H8O | 60,096 | 18,6929 | 3640,20 | -53,54 | 0 … +101 | 82,2 | ||
| н -Бутанол | C4H10O | 74,123 | 17,2160 | 3137,02 | -94,43 | +15 … +131 | 117,7 | ||
| Муравьиная кислота | CH2O2 | 46,025 | 16,9882 | 3599,58 | -26,09 | -2 … +136 | 100,6 | ||
| Уксусная кислота | C2H4O2 | 60,052 | 16,8080 | 3405,57 | -56,34 | +17 … +157 | 118,0 | ||
| Кетоны, эфиры, хлоруглеводороды | |||||||||
| Ацетон | C3H6O | 58,080 | 16,6513 | 2940,46 | -35,93 | -32 … +77 | 56,2 | ||
| Диэтиловый эфир | C4H10O | 74,123 | 16,0828 | 2511,29 | -41,94 | -48 …+67 | 34,5 | ||
| Этилацетат | C4H8O2 | 88,107 | 16,1516 | 2790,50 | -57,15 | -13 … +112 | 77,2 | ||
| Изобутилацетат | C6H12O2 | 116,160 | 16,1714 | 3092,83 | -66,15 | +16 … +154 | 116,8 | ||
| Дихлорметан | CH2Cl2 | 84,933 | 16,3029 | 2622,44 | -41,70 | -44 … +59 | 39,8 | ||
| Трихлорметан | CHCl3 | 119,378 | 15,9732 | 2696,79 | -46,16 | -13 … +97 | 61,2 | ||
| 1,2-Дихлорэтан | C2H4Cl2 | 98,960 | 16,1764 | 2927,17 | -50,22 | -33 … +100 | 83,4 | ||
| Трихлор-этилен | C2HCl3 | 131,389 | 16,1827 | 3028,13 | -43,15 | -13 … +127 | 87,2 | ||
| Тетрахлор-этилен | С2Сl4 | 165,834 | 16,1642 | 3259,29 | -52,15 | +34 … +187 | 121,1 | ||
| Неорганические вещества | |||||||||
| Вода | H2O | 18,015 | 18,3036 | 3816,44 | -46,13 | +8 … +168 | |||
| Серы диоксид | SO2 | 64,063 | 16,7680 | 2302,35 | -35,97 | -78 … +7 | -10,0 | ||
| Аммиак | NH3 | 17,031 | 16,9481 | 2132,50 | -32,98 | -94 … -12 | -33,4 | ||
| Хлор | Cl2 | 70,906 | 15,9610 | 1978,32 | -27,01 | -101 … -9 | -34,4 | ||
| Углерода диоксид | CO2 | 44,010 | 22,5898 | 3103,39 | -0,16 | -119 … -69 | -78,4 |
13. Рид Р., Праусниц Дж., Шервуд Т. Свойства газов и жидкостей. Справочное пособие.– Л.: Химия, 1982. – 592 с.
Задание 3.
Изучите теоретическую часть описания состава многокомпонентных смесей с использованием электронной таблицы MS Excel.
При составлении общего и покомпонентных материальных балансов процессов используют количества веществ, выраженные в единицах массы mi (кг) или в мольных единицах ni (кмоль). Эти величины для i-го вещества взаимосвязаны между собой соотношением
 , (6)
, (6)
где Mi –молярная масса i-го вещества, кг/кмоль.
Мольное количество веществ необходимо учитывать при расчете материального баланса химических процессов.
При расчете материального баланса процессов состав смесей описывают массовыми или мольными долями отдельных компонентов в смеси
 , (7)
, (7)
где m∑ – масса всего раствора, смеси веществ, кг; n∑ – суммарное количество всех веществ в смеси, растворе, кмоль.
Мольную долю отдельного компонента в смеси газов или паров обозначают, как правило, буквой у. В идеальной газовой смеси она равна доле парциального давления pj от общего давления p∑ или доле парциального объема Vj к общему объему V∑ (5).
Параметры равенства (5) взаимосвязаны между собой уравнением состояния идеального газа
 (8)
(8)
где Т – абсолютная температура, К; R µ = 8314 Дж/(кмоль·К) – универсальная газовая постоянная.
Средняя мольная масса смеси веществ представляет отношение общей массы к числу молей веществ в смеси, кг/кмоль
 (а);
(а);  (б). (9)
(б). (9)
Плотность газа и газовых смесей при значениях абсолютного давления р и абсолютной температуры Т без учета их сжимаемости вычисляют по уравнению Клапейрона (3)
При подстановке в уравнение (3) парциального давления паров летучего вещества получают парциальную плотность, которая представляет массовую концентрацию этого вещества в парогазовой смеси, сmi, кг/м3.
Составы материальных потоков в MS Excel описывают в форме таблицы 3. Базовые числовые значения исходных данных вводят в верхнюю часть, эти ячейки выделяют зеленым цветом (варьируемые параметры).
В столбцы А, В, С основной части вводят данные о веществах, входящих в состав смеси: порядковый номер, формулу вещества, его мольную массу.
В ячейки D21:G21 строки «Сумма» вводят формулу суммирования из строк 11:20 и выделяют полужирным шрифтом.
Пример 3.1. При жидкофазном хлорировании бензола получили 2345 кг реакционной смеси, которая содержит, % масс.: хлорбензол – 60,8; дихлорбензолы – 7,0; остальное – бензол.
Рассчитать:
- массы отдельных компонентов в смеси в кг;
- количества компонентов в кмолях;
- мольные доли компонентов в смеси;
- среднюю мольную массу реакционной смеси, кг/кмоль.
Решение.
1. Веществам компонентов смеси присваивают порядковые номера:
1 – бензол, 2 – хлорбензол, 3 – дихлорбензолы.
2. На отдельном листе MS Excel создают таблицу 3, которой дают имя «Пример 3.1». Оформляют верхнюю часть таблицы. В ячейку D5 вводят массу смеси и выделяют ячейку зеленым цветом.
В ячейку D23 вводят формулу копирования =D5.
3. В область А11: С13 вводят список веществ в соответствии с принятыми порядковыми номерами и значения их мольных масс.
| A | B | C | D | E | F | G | |
| Таблица 3 – Состав материального потока | |||||||
| Пример расчета 3.1 | |||||||
| Исходные данные: | |||||||
| Масса смеси | кг | ||||||
| Формула вещества | М, кг/кмоль | Номер потока на блок-схеме | |||||
| кг | масс. доля | кмоль | мольн. доля | ||||
| С6Н6 | 78,114 | m 1 | w 1 | n 1 | x 1 | ||
| С6Н5Сl | 112,559 | m 2 | w 2 | n 2 | x 2 | ||
| C6H4Cl2 | 147,004 | m 3 | w 3 | n 3 | x 3 | ||
| Сумма | ∑ mj | ∑ wj | ∑ nj | ∑ xj | |||
| ПОТОК | =D5 | 1,000 | 1,000 | ||||
| Баланс | =D21-D23 |
4.В ячейки D21:G21 строки 21 вводят формулу суммирования D21:=СУММ(D11:D20) числовых значений из строк 11-20 для всех компонентов. Строки 23 и 24 используют для контроля правильности расчетов.
5. В ячейку Е12 вводят значение массовой доли хлорбензола в смеси 0,608; в ячейку Е13 – значение массовой доли дихлорбензолов 0,070. Выделяют эти ячейки зеленым цветом. В ячейку Е11 вводят формулу вычисления массовой доли бензола в смеси Е11: = 1– СУММ(Е12:Е13).
6. В ячейки D11:D13 вводят формулу расчета массы компонентов D11:= D$23*E11 (числовое значение общей массы смеси берут из ячейки D23). При отсутствии ошибок в ячейке D24 должно получиться нулевое значение 0,000.
7. В ячейки F11: F13 записывают формулу (6) расчета количества веществ в кмолях, а в ячейки G11:G13 – формулу расчета мольных долей (7).
8. В ячейку С23 записывают формулу расчета средней мольной массы реакционной смеси (9а). Получают, что реакционная смесь имеет среднюю мольную массу 100 кг/кмоль. При изменении общей массы смеси эта величина не меняется.
Пример 3.2. Заданы значения мольных долей всех компонентов хj и масса k-го компонента mk. Рассчитать в форме таблицы 3.1 значения остальных величин.
Решение. В ячейки G11:G20 записывают значения мольных долей всех компонентов хj, а в ячейку D k – значение mk. Используя эти данные, последовательно вычисляют значения nk, n ∑, ni≠k, mi≠k, m ∑, wi по уравнениям
 (10)
(10)
В ячейку F24 для проверки вычислений вводят формулу расчета баланса для данного потока =F21–F23.
Пример 3.3. В стальном баллоне объемом 60 дм3 находится пропан - бутановая смесь с мольным соотношением 3:1 под избыточным давлением 0,30 МПа при температуре 27оС. Рассчитайте массы пропана и бутана в баллоне, считая газовую смесь в баллоне идеальной.
Решение. Вводят индексы: 1 – пропан, 2 – бутан.
Мольные массы веществ, из справочника [13, с.543, с.546], кг/кмоль
М 1 = 44,097, М 2 = 58,124.
Мольные доли пропана и бутана в смеси
 .
.
Абсолютное давление газов в баллоне, Па

Общее количество газов по уравнению (8), кмоль
 .
.
Масса пропана и бутана в баллоне, кг

Средняя мольная масса смеси в баллоне по уравнениям (9а) и (9б), кг/кмоль

 .
.
Расхождение 47,606 – 47,604 = 0,002 (0,004%) обусловлено использованием округлений в вычислениях.
Задача 3.1. Парогазовая смесь содержит пять веществ. Молярные доли компонентов приведены в таблице 4, их молярные массы – в таблице 5.
Опишите последовательность расчета и рассчитайте полный состав данной смеси по форме таблицы 3 при заданной массе в смеси одного компонента.
Таблица 4 – Исходные данные для задачи 3.1.
| Вари-ант | Объемная (молярная) доля вещества в смеси | Заданная масса | ||||||
| H2 | CO | CO2 | H2O | СН4 | N2 | ве-щество | кг | |
| 0,191 | 0,164 | 0,227 | 0,009 | 0,091 | до 100% | CO | 50,42 | |
| 0,100 | до 100% | 0,133 | 0,017 | 0,167 | 0,292 | H2 | 2,419 | |
| 0,154 | 0,138 | до 100% | 0,023 | 0,231 | 0,269 | СН4 | 48,13 | |
| 0,214 | 0,100 | 0,157 | до 100% | 0,250 | 0,250 | N2 | 98,05 | |
| 0,213 | 0,087 | 0,100 | 0,033 | до 100% | 0,233 | CO2 | 66,02 | |
| 0,156 | 0,100 | 0,175 | 0,038 | 0,313 | до 100% | H2O | 10,81 | |
| 0,241 | 0,159 | 0,165 | 0,041 | до 100% | 0,206 | H2 | 8,266 | |
| 0,128 | 0,211 | 0,133 | до 100% | 0,289 | 0,194 | CO | 106,4 | |
| до 100% | 0,147 | 0,168 | 0,047 | 0,226 | 0,184 | CO2 | 140,8 | |
| 0,235 | до 100% | 0,150 | 0,050 | 0,250 | 0,175 | СН4 | 80,22 | |
| 0,248 | 0,152 | до 100% | 0,052 | 0,262 | 0,167 | N2 | 98,05 | |
| 0,218 | 0,223 | 0,209 | 0,055 | до 100% | 0,159 | H2O | 21,62 | |
| 0,265 | 0,143 | 0,122 | 0,057 | 0,261 | до 100% | H2 | 12,30 | |
| до 100% | 0,196 | 0,217 | 0,058 | 0,146 | 0,146 | CO | 131,6 | |
| 0,204 | 0,176 | до 100% | 0,060 | 0,300 | 0,140 | СН4 | 120,3 | |
| 0,285 | 0,215 | 0,185 | 0,062 | до 100% | 0,135 | N2 | 98,05 | |
| 0,204 | 0,174 | 0,115 | до 100% | 0,315 | 0,130 | CO2 | 136,4 | |
| 0,161 | 0,136 | до 100% | 0,064 | 0,321 | 0,125 | СН4 | 144,4 | |
| до 100% | 0,159 | 0,162 | 0,066 | 0,179 | 0,121 | CO | 128,8 | |
| 0,273 | 0,133 | 0,090 | 0,067 | 0,320 | до 100% | H2O | 36,03 |
Таблица 5 – Молярные массы веществ
| Вещество | N2 | H2 | CO | CO2 | H2O | СН4 |
| Молярная масса, кг/кмоль | 28,014 | 2,016 | 28,010 | 44,010 | 18,015 | 16,043 |
Таблица 6 – Выборочные ответы для самоконтроля
| Вари- ант | Массовая доля СО2 | Вари- ант | Массовая доля N2 | Вари- ант | Массовая доля СО2 | Вари- ант | Массовая доля H2 |
| 39,2% | 27,1% | 26,4% | 2,7% | ||||
| 23,1% | 26,6% | 39,1% | 2,0% | ||||
| 33,9% | 23,7% | 27,6% | 1,4% | ||||
| 31,9% | 23,8% | 41,5% | 3,2% | ||||
| 22,3% | 23,6% | 25,8% | 3,1% |
ЛИТЕРАТУРА
1. Беркман Б.Е. Основы технологического проектирования производство органического синтеза. М.: Химия, 1970. – 368с.
2. Основы проектирования химических предприятий и элементы систем автоматизированного проектирования / С.П. Рудобашта, Г.С. Кормильцин, А.А. Лапин, Э.Л. Тудоровский, М.: МИХМ, 1985 – 80с.
3. Основы проектирования химических производств / С.И. Дворецкий, Г.С. Кормильцин, В.Ф. Калинин. М.: Машиностроение-1, 2005 – 180с.
4. СНиП 11-01-95. Инструкция о порядке разработки, согласования, утверждения и составе проектной документации на строительство предприятий, зданий и сооружений.
5. Тимофеев В.С., Серафимов Л.А. Принципы технологии основного органического и нефтехимического синтеза. М.: Химия, 1992 – 432с.
6. Перевалов В.п., Колдобский Г.И. Основы проектирования и оборудование производств тонкого органического синтеза. М.: Химия, 1997 – 288 с.
7. Гунич С.В., Янчуковская Е.В. Математическое моделирование и расчет на ЭВМ химико-технологических процессов. Примеры и задачи. Части I и 2: учеб. пособие. – Иркутск: Изд-во ИрГТУ, 2010. – 216 с.
8. Методические указания к практикуму по курсу «Математическое моделирование химико-технологических процессов». Учебно- методическое пособие. /Авт.: Закгейм А.Ю., Шишилов О.Н., Кацман Е.А.Под ред. Закгейма А.Ю., Изд. 3-е, перераб. – М.: ИПЦ МИТХТ им. М.В. Ломоносова, 2010. – 36 с.
9. Моделирование систем: учебное пособие / И.А. Елизаров, Ю.Ф. Мартемьянов, А.Г. Схиртладзе, А.А. Третьяков. – Тамбов: Изд-во ФГБОУ ВПО «ТГТУ», 2011. – 96 с.
10. Рид Р., Праусниц Дж., Шервуд Т. Свойства газов и жидкостей: Справочное пособие/ пер. с англ. под ред. Б.И. Соколова. – 3-е изд., перераб. и доп. – Л.: Химия, 1982. – 592 с.
11. Практическое руководство по решению некоторых вычислительных задач с использованием MICROSOFT EXCEL: учеб. пособие под ред. д.т.н. проф. Т.Н. Гартман. – М.: РХТУ им. Д.И. Менделеева, 2006. – 64 с.
Пример титульного листа
Новочебоксарский химико-механический техникум Минобразования Чувашии
Заочное отделение
Специальность 18.02.06 Химическая технология органических веществ
Домашняя контрольная работа №
Студента группы _______________
______________________________________________
(Ф.И.О. студента)
Шифр _____________ вариант № _____________
Предмет МДК.04.01 Тема 1 Проектирование современных технологических производств
(название)
Дата сдачи работы _____________________________
Преподаватель Павлова В.А.
(Ф.И.О.)
Оценка ________ Дата проверки ________________
Подпись преподавателя ____________
______________________________________________________
Контрольная работа предъявляется экзаменатору при сдаче экзамена