Соли - сложные вещества, состоящие из атомов металлов (иногда входит водород) и кислотных остатков (табл.8).
Таблица 8. Классификация солей по составу
| СОЛИ | Средние (нормальные) - продукт полного замещения атомов водорода в кислоте на металл | AlCl3 |
| Кислые(гидросоли) - продукт неполного замещения атомов водорода в кислоте на металл | КHSO4 | |
| Основные (гидроксосоли) -продукт неполного замещения ОН-групп основания на кислотный остаток | FeOHCl | |
| Двойные - содержат два разных металла и один кислотный остаток | КNaSO4 | |
| Смешанные - содержат один металл и несколько кислотных остатков | CaClBr | |
| Комплексные | [Cu(NH3)4]SO4 |
Названия солей
| Кислотный остаток (анион) | Название соли | Кислотный остаток (анион) | Название соли |
| Cl- | хлорид | SiO32- | силикат |
| F- | фторид | PO43- | фосфат |
| NO3- | нитрат | CN- | цианид |
| NO2- | нитрит | NCS- | тиоционат |
| S2- | сульфид | ClO- | гипохлорит |
| SO32- | сульфит | ClO2- | хлорит |
| SO42- | сульфат | ClO3- | хлорат |
| CO32- | карбонат | ClO4- | перхлорат |
Если металл имеет переменную валентность, то она указывается после химического элемента римской цифрой, заключённой в скобки. Например, CuSO4- сульфат меди (II).
Физические свойства. Соли - это кристаллические вещества разных цветов и разной растворимости в воде. Основные химические свойства солей приведены в таблице 9.
Таблица 9. Химические свойства солей
| 1. Диссоциация Средние, двойные и смешанные соли диссоциируют одноступенчато. У кислых и основных солей диссоциация происходит ступенчато. |
NaCl → Na+ + Cl–.
КNaSO4 → К+ + Na+ + SO42–.
CaClBr → Ca2+ + Cl –+ Br–.
КHSO4 → К+ + НSO4– HSO4–  H+ + SO42–.
FeOHCl → FeOH+ + Cl– FeOH+ H+ + SO42–.
FeOHCl → FeOH+ + Cl– FeOH+  Fe2+ + OH–.
[Cu(NH3)4]SO4 → [Cu(NH3)4]2+ + SO42– [Cu(NH3)4]2+ Fe2+ + OH–.
[Cu(NH3)4]SO4 → [Cu(NH3)4]2+ + SO42– [Cu(NH3)4]2+  Cu2+ + 4NH3. Cu2+ + 4NH3.
|
| 2. Взаимодействие с индикаторами. В результате гидролиза в растворах солей накапливаются ионы Н+ (кислая среда) или ионы ОН– (щелочная среда). Гидролизу подвергаются растворимые соли, образованные хотя бы одним слабым электролитом. Растворы таких солей взаимодействуют с индикаторами |
индикатор + Н+ (ОН–)  окрашенное соединение.
AlCl3 + H2O окрашенное соединение.
AlCl3 + H2O  AlOHCl2 + HCl Al3+ + H2O AlOHCl2 + HCl Al3+ + H2O  AlOH2+ + H+ (среда кислая) AlOH2+ + H+ (среда кислая)
|
| 3. Разложение при нагревании. |
При нагревании некоторых солей они разлагаются на оксид металла и кислотный оксид:
СаСO3 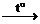 СаO + СО2.
соли бескислородных кислот при нагревании могут распадаться на простые вещества:
2AgCl СаO + СО2.
соли бескислородных кислот при нагревании могут распадаться на простые вещества:
2AgCl 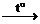 Ag + Cl2
Соли, образованные кислотами-окислителями, разлагаются сложнее:
2КNO3 Ag + Cl2
Соли, образованные кислотами-окислителями, разлагаются сложнее:
2КNO3 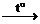 2КNO2 + O2. 2КNO2 + O2.
|
| 4. Взаимодействие с кислотами |
| Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок. 2HCl + Na2CO3 2NaCl + CO2 + H2O 2H+ + CO32– CO2 + H2O. СaCl2 + H2SO4 CaSO4 + 2HCl Сa2+ + SO4 CaSO4 Основные соли при действии кислот переходят в средние: FeOHCl + HCl FeCl2 + H2O. Средние соли, образованные многоосновными кислотами, при взаимодействии с кислотами образуют кислые соли: Na2SO4 + H2SO4 2NaHSO4. |
| 5. Взаимодействие со щелочами. |
| Со щелочами реагируют соли, катионам которых соответствуют нерастворимые основания. CuSO4 + 2NaOH Cu(OH)2 + Na2SO4 Cu2+ + 2OH– Cu(OH)2. |
| 6. Взаимодействие друг с другом. |
| Реакция происходит, если взаимодействуют растворимые соли и при этом образуется осадок. AgNO3 + NaCl AgCl + NaNO3 Ag+ + Cl– AgCl. |
| 7. Взаимодействие с металлами. |
| Каждый предыдущий металл в ряду напряжений вытесняет последующий за ним из раствора его соли: Fe + CuSO4 Cu + FeSO4 Fe + Cu2+ Cu + Fe2+. Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au |
| 8. Электролиз (разложение под действием постоянного электрического тока). |
Соли подвергаются электролизу в растворах и расплавах:
2NaCl + 2H2O  H2+ 2NaOH + Cl2
2NaClрасплав H2+ 2NaOH + Cl2
2NaClрасплав  2Na + Cl2 2Na + Cl2
|
| 9. Взаимодействие с кислотными оксидами |
СО2 + Na2SiO3 Na2CO3 + SiO2
Na2CO3 + SiO2 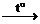 СО2 + Na2SiO3 СО2 + Na2SiO3
|