Кафедра «Химии и фармацевтической химии»
Контрольная работа №2
по дисциплине
«Фармацевтическая химия»
Выполнила: студентка 31 ФЗ группы
Камалетдинова Л. Р.
Проверила:
Оренбург, 2016.
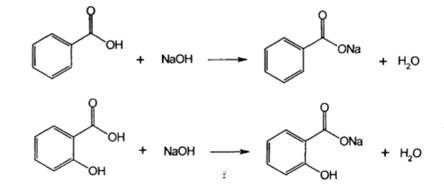
Покажите связь строения c химическими свойствами и анализом качества лекарственных веществ производных ароматических кислот. Кислота бензойная, натрия бензоат, кислота салициловая, натрия салицилат, осалмид (оксафенамид), кислота ацетилсалициловая.
Ароматическиекислоты – производныеароматическихуглеводородов, у которых в бензольномядреодинилинесколькоатомовводородазамещеныкарбоксильнымигруппами.
| Лекарственное вещество | Химическая формула |
| Кислота бензойная (Acidumbenzoicum) | 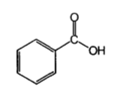
|
| Натрия бензоат (Natriibenzoas) | 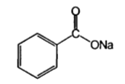
|
| Кислота салициловая (Acidumsalicylicum) | 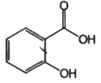
|
| Натрия салицилат (Natriisalicylas) | 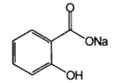
|
| Осальмид (Оксафенамид) (Osalmid) | 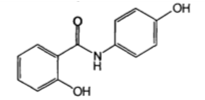
|
За счет наличия в структуре данных веществ карбоксильной группы, возможны следующие реакции:
1. Реакцияэтерификации(образования сложных эфиров). При взаимодействии карбоновых кислот со спиртами в присутствии воодоотнимающих средств (Хлороводородная кислота или серная кислота) образуются сложные эфиры.
2R-COOH + 2С2Н5ОН + Н2SО4 = 2R-COOC2H5 +K2SO4 + 2H2O
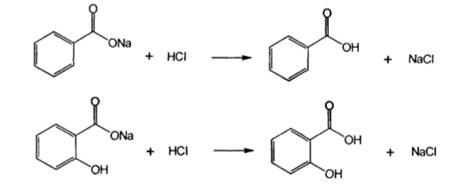
2. Реакцияобразованиясолейтяжелых металлов. Карбоновые кислоты образуют соли и комплексные соли с ионами тяжелых металлов в виде различно окрашенных растворов или осадков. Реакциянатриябензоата с растворомхлоридажелеза (III). В результатереакцииобразуетсяокрашенныйкомплекс в розово-желтыйцвет.
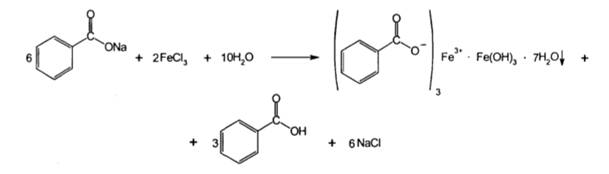
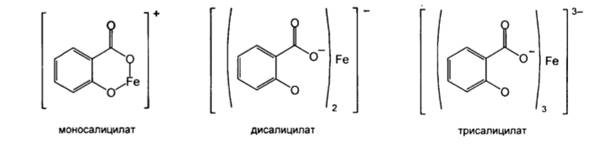
Окраска и состав образующихся комплексов непостоянны и зависят от соотношения лекарственного вещества и реактива, и от рН среды. При рН 2-3 образуется окрашенный в фиолетовый цвет моносалицилат железа, при рН 3-8 – красного цвета дисалицилат, а при рН 8-10 – желтого цвета трисалицилат.
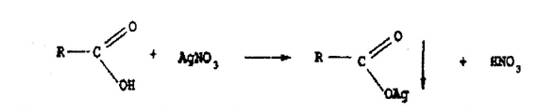
Бензоат- и салицилат-ионы вступают в реакции с другими солями тяжелых металлов. Белые осадки образуются при взаимодействии с раствором нитрата серебра.
Количественное определение:
1. Алкалиметриядлябензойной и салициловой кислот. Метод основан на сильных кислотных свойствах карбоксильной группы. В качестверастворителя – этанол, которыйпредварительнонейтрализуютпофенолфталеину. Затемрастворяютнавеску и титруютрастворомгидроксиданатрия.
2. Ацидиметриядлянатриябензоата и салицилата (метод вытеснения). Метод основан на свойстве сильной минеральной кислоты вытеснять слабую органическую кислоту из ее солиТитруютрастворомхлороводороднойкислоты, используясмешанныйиндикатор – смесьравныхколичествметиловогооранжевого и метиленовогосинего.
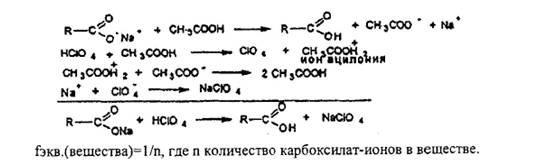
3. Методкислотно-основноготитрования в средепротогенногорастворителя, усиливающиеслабыеосновныесвойствакарбоксилат-иона. Растворителя ледяная уксусная кислота. Титрант – растворкислоты хлорной в ледяной уксусной кислоте, индикатор – раствор кристаллического фиолетового в ледяной уксусной кислоте.
Приведите общие и частные методы качественного анализа сульфаниламидных препаратов. Дайте обоснование, напишите соответствующие реакции на примере стрептоцида, сульфацила-натрия, фталазола.
| Лекарственное вещество | Химическая формула |
| Стрептоцид (сульфаниламид) | 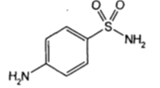
|
| Сульфацил-натрий (сульфацетамид натрия) | 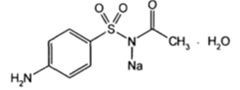
|
| Фталазол (фталилсульфотиазол) | 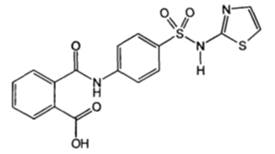
|
Испытания на подлинность:
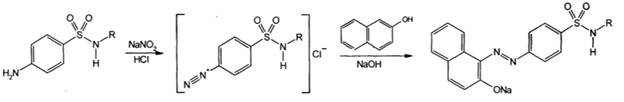
1) Реакцияобразованияазокрасителя. Этообщаяреакциянавсесоединения, содержащие в молекуленезамещеннуюпервичнуюароматическуюаминогруппу. Основананаобразованиихлоридадиазония в результатедействиярастворомнитританатрия и разведеннойхлороводороднойкислотой. Последующеесочетаниехлоридадиазония в щелочнойсреде с феноламиприводит к образованиюазокрасителя. В результатереакциипоявляетсявишнево-красноеокрашиваниеилиобразуетсяосадокоранжево-красногоцвета.
2) Реакцияконденсации. Сульфаниламиды в щелочнойсредеобразуютпродуктыконденсации с 2,4-динитрохлорбензолом (желтогоцвета) и в кислойсредеокрашенныепродуктыконденсации с альдегидамитипашиффовыхоснований. В качествереактивовиспользуютn-диметиламинобензальдегид (желтоеилиорнажевоеокрашивание), ванилин (желтое), формальдегид (желто-оранжевоеилирозовое), уксуснокислыйрастворфурфурола (красноеилималиново-красное).
3) Лигниноваяпроба. Эторазновидностьреакцииобразованияшиффовыхоснований, используемаядляэкспресс-анализа. Онавыполняетсянадревесинеилигазетнойбумаге, принанесениинакоторуюсульфаниламида и каплиразведеннойхлороводороднойкислотыпоявляетсяоранжево-желтоеокрашивание.
4) Реакциягалогенирования. Основанананаличиидонорнойгруппы в ароматическомядремолекулесульфаниламида.
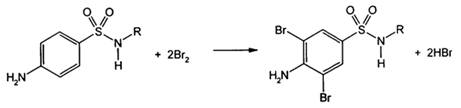
5) Реакцияобнаружениясеры. Наличиесеры в молекулесульфаниламидовможноустановитьпослеокисленияорганическойчастимолекулыконцентрированнойазотнойкислотойилисплавления с 10-кратным количествомнитратакалиядосульфат-иона. Сульфат-ионобнаруживают с помощьюрастворахлоридабария.
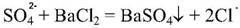
6) Пиролизсульфаниламидов. Притермическомразложениисульфаниламидов в сухойпробиркеплавыприобретаютразличнуюокраску. Одновременнообразуютсягазообразныепродукты. Реакцияпозволяетотличатьнекоторыесульфаниламидыдруготдруга. Например, припиролизестрептоцидаобразуетсясплавфиолетовогоцвета и появляетсязапахаммиака и анилина.
7) Реакция с растворамисолейтяжелыхметаллов. Рядионовтяжелыхметаллов, замещаяподвижныйатомводородасульфамиднойгруппы, образуют с сульфаниламидамивнутрикомплексныесоединения. Нерастворимыекомплексымеди (II) и кобальта (II) имеютразличнуюокраску.
8) Реакция с нитропруссидомнатрия. Растворысульфаниламидов в присутствииедкихщелочейпридобавлении 1% растворанитропруссиданатрия и последующегоподкисленияминеральнойкислотойобразуютокрашенные в красныйиликрасно-коричневыйцветрастворилиосадок.
9) Реакцияокисления. Сульфаниламидыдовольнылегкоокисляются. Приэтомобразуютсяокрашенныесоединенияхиноиднойструктурытипаиндофенолов. Этоиспользуетсядляидентификациисульфаниламидов. Послеихизвлечениякипящейводойдобавляют 3% растворпероксидаводорода и 5% растворхлоридажелеза(III). Сульфаниламид в этихусловияхприобретаеткоричнево-красноеокрашивание, а затемвыпадаетосадокжелто-бурогоцвета.
10) Обнаружениеуксуснойкислотыприкислотномгидролизесульфацетамиданатрия. Сульфацетамиднатрияпридействииуксуснойкислотойвыделяетбелыйосадоксульфацетамида, которыйпослевысушиваниядолжениметьтемпературуплавленияоколо 1830С. Прирастворенииосадка в этаноле и добавленииконцентрированнойсернойкислотыобразуется в этидацетат, имеющийхарактерныйзапах.
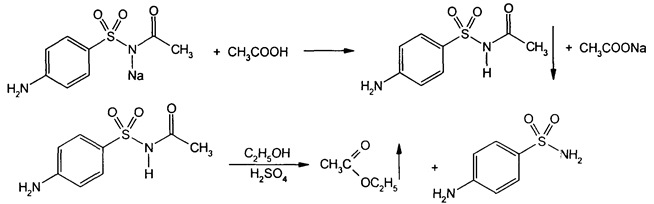
11) Фталилсульфатиазолприсплавлении с резорцином и каплейконцентрированнойсернойкислотыприобретаеторанжево-красноеокрашивание. Послеохлаждения и добавления 2 млрастворагидроксиданатрияотбирают 1 каплюполученнойсмеси и прибавляют к 200 мл. Появляетсяжелтаяокраска с интенсивнойзеленойфлуоресценцией.
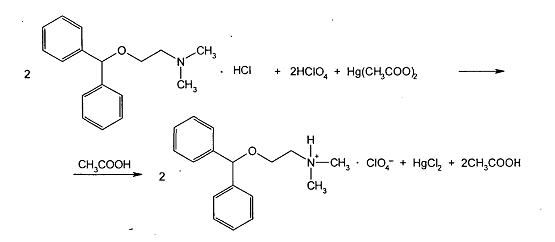
Какой объем 0,1М раствора хлорной кислоты потребуется на титрование 0,3002 г димедрола? Написать уравнение химических реакций, укажите метод, обосновать особенность анализа.
Метод неводного титрования. Титруют в среде безводной уксусной кислоты после добавления ацетата ртути (II). Титрант – раствор хлорной кислоты. Индикатор – кристаллический фиолетовый.
По ФС определение выполняют с теми же титрантом и индикатором, используя в качестве растворителя уксусный ангидрид. В таких условиях отпадает необходимость в добавлении ацетата ртути (II).
| Дано: а = 0,3002 г с = 0,1 моль/л М = 291,82 Найти: V -? | а = V*K*T V = а / К*T Т = Мэкв*с / 1000 Мэкв = М*fэкв Fэкв = 1 Мэкв = 291,82 * 1 = 291,82 г/моль Т = 291,82 * 0,1 / 1000 = 0,02918 г/мл V = 0,3002 / 1*0,02918 = 10,29 мл Ответ: 10,29 мл раствора хлорной кислоты потребуется на титрование. |
Рассчитайте, какой объем раствора кислоты хлороводородной (0,1 моль/л) с К 1,0000 должен израсходоваться при определении азота в кислоте глутаминовой по методу Кьельдаля, если навеска лекарственного вещества 0,1005 г. М.м. кислоты глутаминовой 147,13. А.м. азота 14,01.
Метод Кьельдаля. Метод основан на предварительной минерализации глуаминовой кислоты до гидросульфата аммония. Определение выполняют с помощью колбы Къельдаля, парообразователя, холодильника и приёмника. Оно состоит из нескольких стадий.
Анализируемую смесь смешивают с порошком K2SO4, CuSO4 (10:1). К полученой смеси прибавляют H2SO4. Проводят реакцию в колбе Кьельдаля, соединенной с холодильником и специальным приемником. При нагреве идет минерализация:
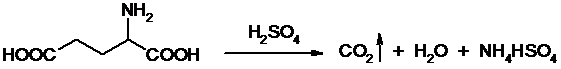
Нагревают до полного просветления раствора, затем колбу охлаждают, прибавляют NaOH. Идет процесс нейтрализации избытка H2SO4, разрушение аммониевой соли.
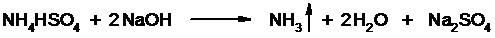
Аммиак в специальном приемнике реагирует с борной кислотой:
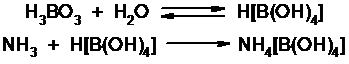
Титруют HCl в присутствии м/о + м/с. Разрушается тетраборат с образованием H3BO4 + NH4Cl.

| Дано: а = 0,1005 г с = 0,1 моль/л М = 147,13 г/моль М(азота) = 14,01 г/моль Найти: V -? | 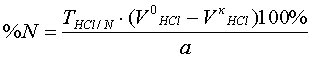
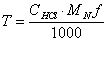 где:
a - масса навески.
V0-общий объем кислоты, в скобках объем кислоты затраченный на реакцию.
Разность между количествами миллилитров 0,1 н. раствора соляной кислоты в основном и контрольном опытах, умноженная на 0,0014, соответствует числу граммов азота во взятой навеске.
Зная процентное содержание азота в смеси можно найти процентное содержание глутаминовой кислоты.
где:
a - масса навески.
V0-общий объем кислоты, в скобках объем кислоты затраченный на реакцию.
Разность между количествами миллилитров 0,1 н. раствора соляной кислоты в основном и контрольном опытах, умноженная на 0,0014, соответствует числу граммов азота во взятой навеске.
Зная процентное содержание азота в смеси можно найти процентное содержание глутаминовой кислоты.
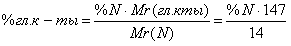 Процентное содержание общего азота в препарате (по ГФ(X)) должно быть в продукте не менее 9,4% и не более 9,55%.
Т.о. разницу объемов высчитывают:
Vо – Vк = G(азота)*а / Т*100%
Т.к. содержание азота должно быть не менее 9,4% и не более 9,55%,следовательно среднее значение – 9,475%.
Тогда:
Mэкв = М*fэкв
Mэкв = 14,01 * 1 = 14,01
Т = 0,1*14,01 /1000 = 0,0014 г/мл
Vо – Vк = 9,475*0,1005 / 0,0014*100 = 6,8 мл
Ответ: Разность между количествами миллилитров раствора соляной кислоты в основном и контрольном опытах 6,8мл.
Процентное содержание общего азота в препарате (по ГФ(X)) должно быть в продукте не менее 9,4% и не более 9,55%.
Т.о. разницу объемов высчитывают:
Vо – Vк = G(азота)*а / Т*100%
Т.к. содержание азота должно быть не менее 9,4% и не более 9,55%,следовательно среднее значение – 9,475%.
Тогда:
Mэкв = М*fэкв
Mэкв = 14,01 * 1 = 14,01
Т = 0,1*14,01 /1000 = 0,0014 г/мл
Vо – Vк = 9,475*0,1005 / 0,0014*100 = 6,8 мл
Ответ: Разность между количествами миллилитров раствора соляной кислоты в основном и контрольном опытах 6,8мл.
|
Определите в лекарственных веществах функциональные группы, способные к образованию азокрасителя без и после предварительной обработки. Напишите химические реакции получения азокрасителя.
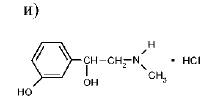
Реакция образования азокрасителя – общая реакция на все соединения, содержащие в молекуле незамещенную ароматическую аминогруппу. Для обнаружения соединений, имеющих заместителей в ароматической аминогруппе, реакцию диазотирования проводят после предварительного кислотного гидролиза.
Реакция образования азокрасителя протекает в две стадии: диазотирования и азосочетания. Ароматический амин взаимодействует с натрия нитритом в солянокислой среде с образованием соли диазония, которая при сочетании с фенолами в щелочной среде или ароматическими аминами в нейтральной и слабощелочной среде образует азокраситель оранжево- или вишнево-красного цвета.
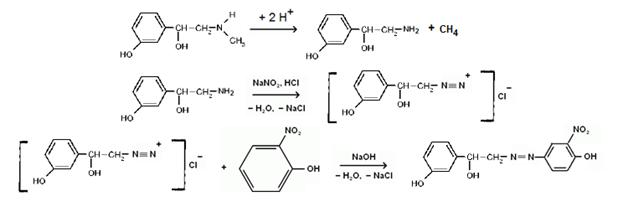
В качестве азосоставляющих и азокомпонентов применяют разнообразные фенолы и ароматические амины.
| Лекарственное вещество | Химическая формула | Лекарственное вещество | Химическая формула |
| Фенол | 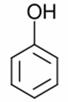
| Резорцин | 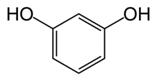
|
| Хинозол | 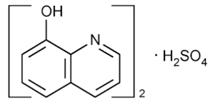
| Анилин | 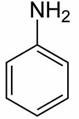
|
Распишите химические реакции разложения лекарственных веществ при воздействии факторов внешней среды (температура, влага, углекислота, кислород воздуха). Опишите условия хранения лекарственных веществ.
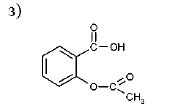 Кислота ацетилсалициловая.
Кислота ацетилсалициловая.
Кислота ацетилсалициловая представляет собой сложный эфир салициловой и уксусной кислот. Кислота ацетилсалициловая – бесцветные кристаллы или белый кристаллический порошок без запаха или со слабым запахом. Она мало растворима в воде, но легко растворима в растворах гидроксидов щелочных металлов, этаноле, хлороформе.
Хранят в сухом месте, в хорошо укупоренной таре. Она устойчива в сухом воздухе, во влажном – постепенно гидролизуется с образованием кислот уксусной и салициловой.
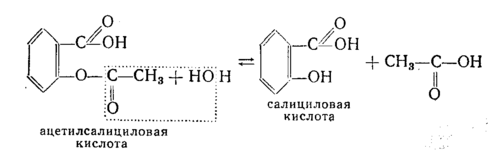
Аналогичный процесс идет в условиях высокой температуры при добавлении нескольких капель воды.
Натрия вальпроат. Приведите полный фармакопейный анализ лекарственных средств (привести структурную формулу, латинское название препарата, описать способ получения, привести описание препарата, его свойства, написать реакции определения подлинности, испытания на чистоту, количественного определения, описать хранение, применение, форма выпуска).
Натрия вальпроат относится к карбоновым кислотам алифатического ряда, которые представляют собой производные углеводородов, у которых один атом водорода замещен карбоксильной группой.
Получение:
Одним из способов получения натрия вальпроата является синтез на основе малонового эфира.
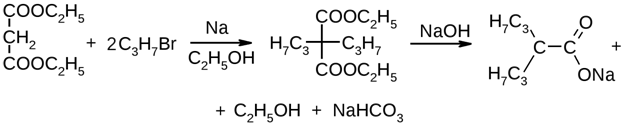
| Лекарственное вещество | Химическая формула |
| Натрия вальпроат (Valproicacidsodiumsalt) | 
|
Натрия вальпроат – белый или почти белый кристаллический порошок без запаха или почти без запаха.Легко растворим в воде и в этаноле.
Испытания на подлинность:
· Натриявальпроат с растворомнитратакобальтаобразуетпурпурныйосадоквальпроатакобальта.
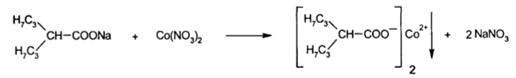
· Реакцияосаждения с цинкуранилацетатомнакатионнатрия в уксусно-кислойсреде. В результате – зеленовато-желтыйкристаллическийосадок.
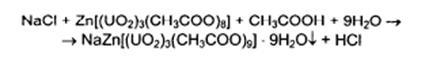
· Подлинностьионанатрияустанавливаютпоокрашиваниюбесцветногопламенигорелки в желтыйцвет.
Количественное определение:
1. Методкислотно-основноготитрования в неводнойсреде. Определяютсодержаниенатриявальпроата, используя в качествеиндикатора 1-нафтолбензеин иликристаллическийфиолетовый.

2. Методкислотно-основноготитрования в воднойсредедлянатриявальпроата. Титрант – 0,5М растворхлороводороднойкислоты. Индикатор – метиловыйоранжевый.
Хранение: Натрия вальпроат хранят в сухом, прохладном, защищенном от света месте при температуре до 25оС в хорошо укупоренной таре.
Применение. Кислота вальпроевая и ее натриевая соль как противоэпилептическое средство широкого спектра действия.
Фенотерола гидробромид (беротек). Приведите полный фармакопейный анализ лекарственных средств (привести структурную формулу, латинское название препарата, описать способ получения, привести описание препарата, его свойства, написать реакции определения подлинности, испытания на чистоту, количественного определения, описать хранение, применение, форма выпуска).
Фенотерола гидробромид (Беротек)
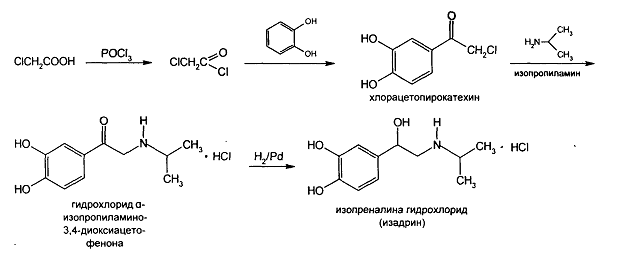
Получение:
Синтезируют фенотерола гидробромид на основе изопреналина. Синтез изопреналина гидрохлорида был осуществлен во ВНИХФИ. Схема промышленного метода получения из хлоруксусной кислоты и пирокатехина.
Описание и свойства:
Фенотерола гидробромид растворим в воде и умеренно растворим в этаноле, в эфире практически нерастворимы.
| Лекарственное вещество | Химическая формула |
| Фенотерола гидробромид (Беротек) | 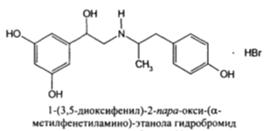
|
Испытания на подлинность:
· С помощью ИК-спектров. Онидолжныбытьидентичныспектрамсоответствующихстандартныхобразцов.
· С помощью УФ-спектров. УФ-спектрраствораизопреналинагидрохлорида в 0,1 М хлороводороднойкислотехарактеризуетсяналичиемдвухмаксимумовпоглощения – в области 223 и 279 нм. Фенотеролагидробромид в 0,01 М растворехлороводороднойкислотыимеетмаксимумпри 276 нм.
· Реакциякомлексообразования с ионамижелеза (III). Образуютсяокрашенныекомплексныесоединенияразличающиесяпоокраске в зависимостиотколичества и местаположениягидроксильныхгрупп, в данномслучаеобразуетсяизумрудно-зеленоеокрашивание, переходящееоткаплирастворааммиака в вишнево-красное, а затем в оранжево-красное.
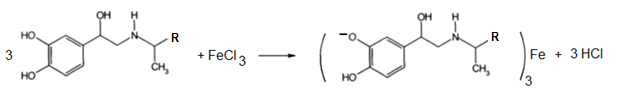
· Реакцияазосочетания. В результатеобразуетсяокрашенноевишнево-красноеазосоединение. Азосочетаниеотносится к реакциямэлектрофильногозамещения, в которыхдиазокатионявляетсясильнымэлектрофильнымреагентом.Сочетаниевсегдапроисходит в пара-положение, а еслионозанято, то в орто-положение.Диазосоединение, участвующее в реакцииазосочетанияназываетсядиазосоставляющей, а ароматическиеаминыилифенолы, вводимые в реакциюазосочетания – азосоставляющей.
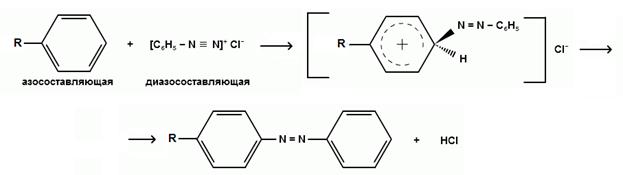
· Реакцияосаждения с нитратомсеребра. В результатеобразуетсяосадоксветло-желтогоцвета, малорастворимый в раствореаммиака.
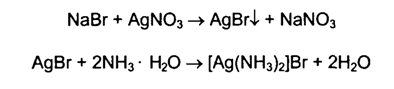
· Реакцияокислениябромидадосвободногоброма, используя в качествеокислителяхлорамин в присутствиихлороводороднойкислоты. Образующийсябромизвлекаютхлороформом и наблюдаютокраскухлороформногослоя. Слойхлороформаокрашивается в желто-бурыйцвет.
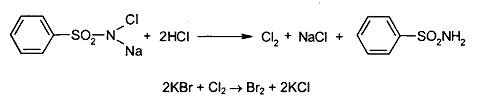
Испытание на чистоту:
Посторонние примеси в фенотероле гидробромиде устанавливают методом ТСХ на пластинках Силуфол УФ-254 по наличию и расположению пятен или по значению Rf.
Количественное определение:
Спектрофотометрический метод. Для фенотерола гидробромида проводят в максимуме поглощения при длине волны 276 нм. Растворителем и раствором сравнения служит 0,01 М раствор хлороводородной кислоты.
Хранение:
Хранят по списку Б, в защищенном от света месте, учитывая склонность к окислению.
Применение:
Фенотерола гидробромид – адреномиметическое средство. Он стимулирует работу сердца, расслабляет мускулатуру бронхов, желудка, кишечника. Используется для купирования и лечения приступов бронхиальной астмы в виде 0,5-1% растворов для ингаляций и аэрозолей.
Салициламид.Приведите полный фармакопейный анализ лекарственных средств (привести структурную формулу, латинское название препарата, описать способ получения, привести описание препарата, его свойства, написать реакции определения подлинности, испытания на чистоту, количественного определения, описать хранение, применение, форма выпуска).
Салициламид.
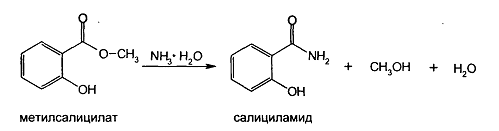
Получение:
Исходными продуктами для синтеза служат сложные эфиры салициловой кислоты. Салициламид получают действием 25% раствора аммиака на метилсалицилат:
Описание и свойства:
Салициламид – белый кристаллический порошок. Салициламидмало растворим в воде, растворим в этаноле, умеренно растворим в эфире, мало растворим в хлороформе.
| Лекарственное вещество | Химическая формула |
| Салициламид (Salicylamide) | 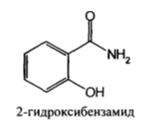
|
Подлинность:
· Реакциякомплексообразования с растворомхлоридажелеза (III). В результатеобразуетсякрасно-фиолетовоеокрашивание.
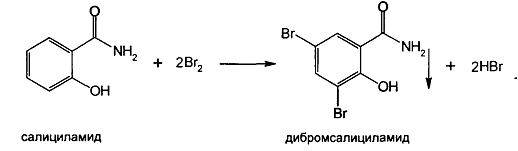
· Реакцияобразованиядибромпроизводногоблагодаряналичиюфенольногогидроксила.
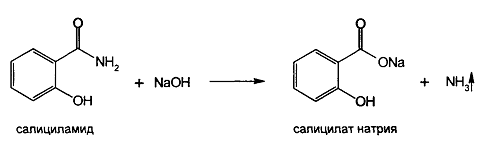
· Реакция гидролиза в щелочной или кислой среде. Амиднуюгруппуобнаруживаютповыделениюаммиака (запах, изменениеокраскикраснойлакмусовойбумаги) прикипячениисалициламида в 30% растворегидроксиданатрия.
· Цветная реакция с азотистой кислотой в присутствии концентрированной серной кислоты. В результате образуется розовое окрашивание.
· Реакция образования индофенола при взаимодействии с 2,6-дихлорхинонхлоримидом. Слойсалициламидаокрашивается в синийцвет.
· Реакция осаждения с 5% раствором сульфата титана. Образуется осадок желтого цвета.
Количественное определение:
1) Методневодноготитрования. Титрант – 0,1 М раствор гидроксида натрия в смеси метанола и бензола. Индикатор – ализариновый желтый Р. Титруют до ярко-лилового окрашивания.
2) Броматометрическоетитрования. Основанонаобразованииамида 3,5-дибромсалициловой кислоты. Выпавшийосадокдибромсалициламиданемешаетопределениюизбыткабромидакалия, поэтомудобавляютйодидкалия и выделившийсяйодоттитровывают 0,1 М растворомтиосульфатанатрия.
Хранение: в хорошо укупоренной таре, в сухом, защищенном от света месте. При хранении следует учитывать способность салициламида возгоняться.
Применение: в качестве противоревматического, противовоспалительного, болеутоляющего и жаропонижающего средства.
Приведите уравнения реакций количественного определения хлоралгидрата (Мг 165,40) по методике ФС, индикатор (название, формулу, переход окраски в точке конца титрования).
Рассчитайте содержание хлоралгидрата в анализируемом образце (%), если к навеске массой 0,3308 г добавлено 35,0 мл ОД моль/л раствора натрия гидроксида (К=1,02). На титрование избытка указанного титранта в основном опыте пошло 16,4мл 0,1 моль/л раствора хлористоводородной кислоты (К=0,99), в контрольном опыте - 36,0 мл того же титранта.
Обратная алкалиметрия. Титрант 1 – раствор натрия гидроксида. Титрант 2 – раствор кислоты хлористоводородной. Около 0,3 г препарата (точная навеска) растворяют в 35 мл 0,1 н. раствора едкого натра, перемешивают и через 2 минуты избыток 0,1 н. раствора едкого натра оттитровывают 0,1 н. раствором соляной кислоты (индикатор -фенолфталеин). Параллельно проводят контрольный опыт. 1 мл 0,1 н. раствора соляной кислоты соответствует 0,01654 г С2H3Cl3O2, которого в препарате должно быть не менее 99,0% и не более 101,0%.
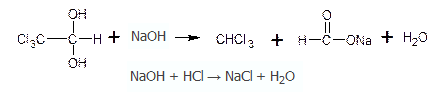
| Дано: а = 0,3308 г с = 0,1 моль/л V = 16,4 мл К = 0,99 Vк = 36 мл M = 165,4г/моль Найти: G -? |  T = Мэкв*с / 1000
Мэкв = fэкв*M
М экв = 1*165,4 = 165,4 г/моль
Т = 165,4 *0,1 / 1000 = 0,01654 г/мл
G = 0,01654* (36*0,99 – 16,4*0,99)*100 / 0,3308 = 97,02%
Ответ: содержание хлоралгидрата в анализируемом образце 97,02%.
T = Мэкв*с / 1000
Мэкв = fэкв*M
М экв = 1*165,4 = 165,4 г/моль
Т = 165,4 *0,1 / 1000 = 0,01654 г/мл
G = 0,01654* (36*0,99 – 16,4*0,99)*100 / 0,3308 = 97,02%
Ответ: содержание хлоралгидрата в анализируемом образце 97,02%.
|
Соответствует ли ацетилсалициловая кислота требованиям ЧФС, если на титрование 0,3222 г препарата пошло 23,4 мл 0,1М раствора гидроксида натрия. Напишите уравнение химических реакций, объясните выбор индикатора, укажите метод.
Метод, основанный на нейтрализации ацетилсалициловой кислоты без предварительного гидролиза. Кислоту ацетилсалициловую растворяют в нейтрализованном и охлажденном этаноле и титруют раствором гидроксида натрия. Индикатор – фенолфталеин.Титруют до появления розового окрашивания.
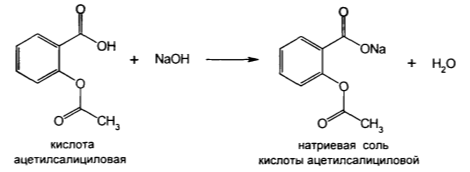
| Дано: а = 0,3222 г с = 0,1 моль/л V = 23,4 мл M = 180,15г/моль Найти: G -? | G = V*K*T*100 / а Т = Мэкв*с / 1000 Мэкв = М*fэкв Fэкв = 1 Мэкв = 180,15 * 1 = 180,15 г/моль Т = 180,15 * 0,1 / 1000 = 0,01802 г/мл G = 23,4*1*0,01802*100 / 0,3222 = 130,87 % Ответ: содержание ацетилсалициловой кислоты 130,87%. В ЧФС указан только верхний допустимый предел – 99,5%. Когда верхний предел содержания в статье не указывают, тогда его значение принимается за 100,5% (см. ГФ ХI, вып. 1, «Правила пользования фармакопейными статьями»).Т.о. ацетилсалициловая кислота не отвечает требованиям ЧФС по показателю «Количественное определение». |
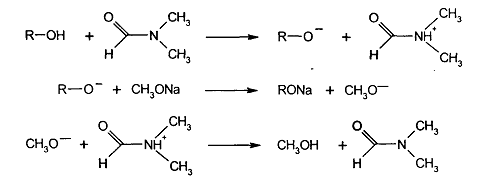
Кислотно-основное титрование в неводных средах и его применение в фармацевтическом анализе. В каких случаях, и для каких лекарственных веществ рекомендуется этот метод? В чем преимущество этого метода перед обычным методом нейтрализации? Приведите уравнения реакций на примере определения димедрола.
Метод кислотно-основного титрования в неводных средах имеет определенные преимущества перед титрованием в водных средах и поэтому включен в ГФ X.
Основное преимущество этого метода заключается прежде всего в том, что он позволяет титровать с достаточной четкостью не только сильные кислоты и основания, но также слабые, очень слабые кислоты, основания, их соли и многокомпонентные смеси часто без их предварительного разделения. Так, этот метод позволяет определять физиологически активную часть в солях алкалоидов. Кроме того, методом неводного титрования можно определять вещества, плохо растворимые в воде.
Нахождение точки конца титрования в неводных средах может осуществляться индикаторным, потенциометрическим, «кондуктометрическим, амперометрическим и другим методами.
К преимуществам этого метода относится также и то, что титрование можно проводить как бесцветных, так и окрашенных растворов. Метод неводного титрования дает более точные результаты по сравнению с точностью титрования водных растворов, так как вследствие небольшого, как правило, поверхностного натяжения органических растворителей размеры капель неводных жидкостей меньше размеров капель водных растворов.
В теории неводного титрования большое значение имеет влияние характера растворителя и природы растворенного вещества на взаимодействие между ионами и молекулами растворителя и растворенного в нем вещества.
Характер растворителя особенно сказывается на кислотно-основных свойствах растворенного вещества.
Определение димедрола проводят титрованием 0,1М раствором хлорной кислоты в среде безводной уксусной кислоты после добавления ацетата ртути (II) с индикатором кристаллическим фиолетовым.
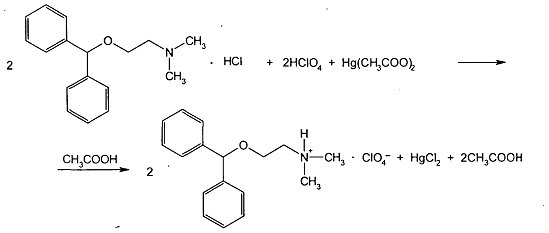
Согласно ФС определение выполняют с теми же титрантом и индикатором, используя в качестве растворителя уксусный ангидрид. В таких условиях отпадает необходимость в добавлении ацетата ртути (II).