МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУК РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное агенство по образованию
Государственное образовательное учреждение высшего профессионального образования
Ростовский государственный строительный университет
Утверждено на заседании
кафедры химии 01.2005 г.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
по теме: «К о р р о з и я м е т а л л о в»
Ростов-на-Дону
УДК 541.2
Методические указания по теме «Коррозия металлов».- Ростов-н∕Д: Рост. гос. строит. ун-т., 2005 г - 8 с.
Рассмотрены понятие и причина коррозионного разрушения металлов, различие химического и электрохимического разрушения металлов, а также явление пассивации металлов. В экспериментальной части дана методика проведения коррозионного эксперимента.
Составитель: доц. Л.М. Астахова
Редактор Н.Е. Гладких
Темплан 2005 г., поз. 167
Подписано в печать 11.04. 05.
Формат 60х84/16. Бумага писчая. Ризограф.
Уч.-изд.л. 0,5 Тираж 100 экз. Заказ
Редакционно-издательский центр
Ростовского государственного строительного университета
344022, Ростов-на-Дону, ул. Социалистическая, 162
© Ростовский государственный
строительный университет, 2005
В силу широчайшего использования различных металлических конструк-ций, аппаратов, приборов коррозионный процесс наносит огромный ущерб на-родному хозяйству. Любой вопрос новой техники сейчас же вызывает необходи-мость решения проблем в области корро-зии. Защита металлов от коррозии не-возможна без знания закономерностей течения этого процесса.
К о р р о з и я - это процесс самопроизвольного разрушения металлов вследствие их взаимодействия с окружающей средой.
Свободный металл (Ме○) является термодинамически неустойчивой формой по сравне-нию с ионной (Ме+n) – ведь в природе металлы, как правило, встреча-ются не в самородном состоянии, а в виде минералов и руд (соли или оксиды ме-таллов).Этим и объясняется само-произвольное разрушение большинства метал-лов. Судить о степени термодинамической не-стабильности можно по величине стандартного электродного потенциала – чем отрицатель-нее эта величина, тем в большей степени металл будет подвержен коррозионному разруше-нию (см. таблицу).
Коррозионный процесс относится к окислительно-восстановительным и включает в себя две сопряженные реакции – окисление и восстановление, например Ме○ + Ок○ → Ме+n + Ок−n,
где окисление: Ме○ − ne → Ме+n;
восстановление: Ок○ + ne → Ок−n.
В зависимости от механизма протекания этих сопряженных реакций коррозия бывает химической или электрохимической.
Химическая коррозия подразумевает процесс взаимодействия металла с окружающей средой за счет гетерогенной химической реакции (атом металла непосредственно взаимо-действует с молекулой реагента и переходит в ионное состояние без переноса электрона через компактный металл). К химической коррозии относятся окисление металлов при вы-соких температурах в газовой атмосфере либо разрушение металла при его соприкоснове-нии с растворами неэлектролитов.
Электрохимическая коррозия протекает с разделением анодной (окисле-ние) и катодной (восстановление)реакций либо в пространстве (по поверхности), либо во времени (если они протекают в одной точке п оверхности). Возникает эта коррозия на границе раздела фаз «металл - электролит» и сопровождается перемещением электронов с одних участков ме-талла к другим, т.е. появлением электрического тока. К ней относят:
- атмосферную коррозию во влажной газовой или воздушной атмосфере;
- подземную коррозию;
- жидкостную коррозию;
- электрокоррозию под действием блуждающих токов и др.
В зависимости от характера разрушений, сопровождающих процесс элект-рохимической коррозии, различают с п л о ш н у ю коррозию, захватывающую всю поверхность металла, и м е с т н у ю, локализующуюся на отдельных участках:
- коррозия пятнами (диаметр поражения велик по сравнению с его глубиной);
- язвенная коррозия (диаметр поражения мал, велика глубина проникновения);
- питтинговая коррозия (точечное поражение, проходящее часто через всю толщу металла) и др.
Скорость коррозии может быть выражена различными способами, однако чаще пользуются весовым, глубинным и токовым показателями.
Весовой или массовый показатель скорости коррозии численно равен потере массы за единицу времени, отнесенную к единице площади:
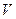 кор = ∆ m/τ•S (г/см2 ч).
кор = ∆ m/τ•S (г/см2 ч).
Глубинный показатель оценивает скорость коррозии по глубине проник-новения коррозионного разрушения в толщу металла за определенный проме-жуток времени: Пгл (мм/год).
Токовый показатель - плотность тока: i (А/см2).
Стандартные электродные потенциалы некоторых металлов (Е○) и общая термодинамическая характеристика их коррозионной стойкости по отношению к водным растворам
| Термодинамическая стабильность металла | Металл и его электродный потенциал (Е○, В) |
| 1. Металлы повышенной нестабильности (неблагородные). Могут корродировать даже в нейтральных средах, не содержащих окислителей | Li (-3,045) Na (-2,714) Cr(II)(-0.913) K (-2,925) Mg (-2,370) Zn (-0,762) Ba(-2,900) Be (-1,850) Cr(III)(-0,740) Ca(-2,870) Al (-1,670) Fe(II)(-0,440) |
| 2. Металлы нестабильные. Устойчивы в ней-тральных средах при отсутствии кислорода, в кислых средах могут корродировать и в от-сутствие кислорода | Cd (-0,402) Pb (-0,126) Co (-0,277) Fe(III) (-0,037) Ni (-0,250) Sn(II) (-0,136) |
| 3. Металлы промежуточной стабильности (полублагородные). В отсутствие О2 и окис-лителей устойчивы в кислых и нейтральных средах | Sn(IV) (+0,007) Ag (+0,799) Cu(II) (+0,337) Cu(I) (+0,521) Hg(I) (+789) |
| 4. Металлы высокой стабильности (благород-ные) не корродируют в нейтральных средах при наличии О2. Могут корродировать в кислых средах при наличии О2 или окислителей | Hg(II) (+0,854) Pd (II) (+0,987) Ir (II) (+1,156) Pt (III) (+1,190) |
| 5. Металлы полной стабильности. Устойчивы в кислых средах при наличии О2. Могут растворяться в комплексообразователях при наличии окислителей | Au (III) (+1,500) Au(I) (+1,680) |
Рассмотрим электрохимическую коррозию на примере действия серной кислоты на технический цинк, содержащий примеси железа. В этом случае на поверхности цинка возникает множество микрогальванопар, в которых цинк яв-ляется анодом (т.к. электродный потенциал цинка (-0,762 В) отрицательнее электродного потенциала железа (-0,44 В), а железо – катодом. Анодный про-цесс в этом случае – окисление цинка, катодный – восстановление окислителя, присутствующего в электролите (катионы водорода):
на аноде Zn○ - 2e = Zn+2 ионизация цинка (окисление);
на катоде 2Н+ + 2e = Н2↑ восстановление катионов водорода.
Поверхность цинка (анод) разрушается, высвободившиеся электроны перетекают к включениям железа (катод), на которых выделяется газообразный водород.
Помимо электрохимического растворения цинк может растворяться и в результате химического процесса: Zn○ + 2Н+ = Zn+2 + Н2↑. Однако опыт показывает, что скорость растворения цинка в этом случае значительно ниже, чем скорость ионизации цинка как анода гальванопары. Вторичный процесс обусловлен взаимодействием образовавшихся катионов металла и кислотного остатка, присутствующего в электролите: Zn+2 + SO4-2 = ZnSO4. Таким обра-зом протекает коррозионный процесс в кислых средах.
Течение коррозионного процесса в нейтральных средах отличается от вышерассмотренного. Например: коррозия технического железа, покрытого пленкой влаги, на воздухе или электролите с нейтральной реакцией среды. Анодный процесс аналогичен – ионизируется металл; на катоде в этом случае восстанавливаются молекулы кислорода, растворенного в воде:
на аноде Fe○ - 2e = Fe+2 ионизация железа (окисление);
на катоде О2 + 2Н2О + 4е = 4ОН- восстановление кислорода.
Возможные вторичные процессы:
Fe+2 + 2ОН- = Fe(ОН)2, 4 Fe(ОН)2 + О2 + 2Н2О = 4Fe(ОН)3 .
Нередко продукты коррозии оказываются малорастворимыми и своим при-сутствием на поверхности металла защищают его от дальнейшего разрушения – пассивируют металл. Это могут быть оксиды, гидроксиды, соли.
П а с с и в а ц и е й или пассивностью металла называется такое его сос-тояние, в каком он не подвергается коррозионному разрушению. Это состояние может быть достигнуто как за счет действия соответствующих окислителей, так и в случае анодной поляризации. Целый ряд металлов уже в естественных усло-виях имеет на своей поверхности оксидную пленку, которая надежно защищает от воздействия агрессивных агентов окружающей среды. Такие металлы называ-ются самопассивирующимися. К ним относятся: алюминий (с термодинамической точки зрения активный металл, но за счет поверхностной оксидной пленки коррозионностойкий), титан, ванадий, молибден, хром, никель и др.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Коррозия химическая и электрохимическая.
В пробирку налить 5 мл 0,01 н серной кислоты, затем опустить в этот раствор полоску цинка (слабое выделение газообразного водорода). Погрузить медную проволоку в раствор (изменяется ли интенсивность выделяющегося водорода?). Прикоснуться медной проволокой к цинку (что наблюдается?).
Объяснить наблюдаемое. В каком случае скорость растворения цинка больше? Составить схему действия образовавшейся гальванопары.
Опыт 2. Образование микрогальванопар.
Поместить гранулу цинка в пробирку и прилить в нее 2 мл разбавленной серной кислоты (что наблюдается?). Добавить в пробирку несколько капель раствора сульфата меди (что наблюдается?). Объяснить наблюдаемое.
Опыт 3. Пассивирующая пленка на алюминии.
Оксидная пленка на алюминии - естественная преграда между термодинамически активным металлом (ЕAL = -1,670 В) и коррозионной средой.
В пробирку налить раствор ртути и опустить в нее алюминиевую проволоку
(что наблюдается?). Опустить другую алюминиевую проволоку в раствор 10 % NaOH и выдержать в нем 5 мин, после чего тщательно промыть проволоку водой (такая обработка позволяет снять оксид с поверхности металла), высушить фильтровальной бумагой. После подготовки опустить эту проволоку в пробирку с раствором соли ртути. Затем вынуть прово-локу на воздух и наблюдать за происходящими изменениями (каков состав вещества,
образующегося на проволоке?). Снять порошок фильтровальной бумагой и опустить проволоку в пробирку с водой (что происходить на поверхности проволоки?).
Сущность этого опыта – амальгамирование алюминия. На амальгамированной поверхности алюминия оксидная пленка практически отсутствует и может проявляться собственно активность алюминия, способного быстро соединяться с кислородом воздуха и вытеснять водород из воды.
Опыт 4. Активирующее действие ионов.
Активирующее действие проявляют ионы хлора. В две пробирки поместить по кусочку алюминиевой проволоки и прилить в них раствор сульфата меди, слегка подкисленный серной кислотой. В одну из пробирок добавить несколько капель раствора хлорида натрия. Объяснить наблюдения. Почему в одной из пробирок реакция протекает быстрее? Составить схему действия полученных гальванопар.
ЗАДАЧИ
1. В раствор соляной кислоты поместили цинковую пластину и цинковую пластину, частично покрытую медью. Где процесс коррозии протекает интенсивнее? Почему? Составить схемы, протекающий процессов.
2. Почему химически чистое железо коррозионноустойчиво?
3. Составить схему анодного и процессов, протекающих при коррозии технического железа во влажном воздухе и сильнокислой среде.
4. Две железные пластины частично покрыты одна оловом, другая медью и находятся во влажном воздухе. На какой пластине быстрее образуется ржавчина? Почему? Каков состав продуктов коррозии? Составить схему работы гальванопар.
5. Что такое химическая и электрохимическая коррозия? Пример.
6. Классификация коррозионных процессов.
7. Принцип работы гальванической системы на примере. Какой металл является анодом в этой системе?
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ